Xem thêm
Tăng cholesterol máu nguyên phát (loại IIa kể cả tăng cholesterol máu gia đình kiểu dị hợp tử) hoặc rối loạn lipid máu hỗn hợp (loại IIb): Là một liệu pháp hỗ trợ cho chế độ ăn kiêng khi bệnh nhân không đáp ứng đầy đủ với chế độ ăn kiêng và các liệu pháp không dùng thuốc khác (như tập thể dục, giảm cân).
Rối loạn beta lipoprotein máu nguyên phát (tăng lipoprotein máu týp III): CRESTOR được chỉ định như là một liệu pháp bổ trợ cho chế độ ăn kiêng trong điều trị bệnh nhân có rối loạn beta lipoprotein máu nguyên phát (tăng lipoprotein máu týp III).
CRESTOR được chỉ định như liệu pháp điều trị bổ trợ cho chế độ ăn kiêng ở những bệnh nhân người lớn có tăng triglycerid.
Tăng cholesterol máu gia đình kiểu đồng hợp tử: Dùng hỗ trợ cho chế độ ăn kiêng và các biện pháp điều trị giảm lipid khác (như gạn tách LDL máu) hoặc khi các liệu pháp này không thích hợp.
Bệnh nhi từ 10 đến 17 tuổi bị tăng cholesterol máu gia đình kiểu dị hợp tử (HeFH): Hỗ trợ chế độ ăn kiêng nhằm làm giảm lượng cholesterol toàn phần, LDL-cholesterol và ApoB trên những bệnh nhân thanh thiếu niên 10 đến 17 tuổi bị tăng cholesterol máu gia đình kiểu dị hợp tử (đối với nữ đã có kinh nguyệt ít nhất 1 năm) nếu những yếu tố sau vẫn còn tồn tại sau khi điều trị bằng chế độ ăn kiêng: LDL-C > 190mg/dL hay > 160mg/dL và có tiền sử gia đình mắc bệnh tim mạch sớm hoặc có 2 hay nhiều hơn yếu tố nguy cơ về bệnh tim mạch.
CRESTOR được chỉ định như liệu pháp điều trị bổ trợ cho chế độ ăn kiêng nhằm làm chậm tiến triển của bệnh xơ vữa động mạch ở bệnh nhân người lớn như là một phần của chiến lược điều trị nhằm giảm cholesterol toàn phần và LDL-C để đạt các mức mục tiêu.
Phòng ngừa bệnh tim mạch nguyên phát:
Ở những cá thể không có bằng chứng lâm sàng về bệnh mạch vành nhưng có nguy cơ bệnh tim mạch như là >= 50 tuổi ở nam giới, >= 60 tuổi ở nữ giới, hsCRP >= 2mg/L và có thêm ít nhất 1 yếu tố nguy cơ bệnh tim mạch như là tăng huyết áp, HDL-C thấp, hút thuốc hoặc có tiền sử gia đình về bệnh mạch vành sớm, CRESTOR được chỉ định:
– Giảm nguy cơ đột quỵ
– Giảm nguy cơ nhồi máu cơ tim
– Giảm nguy cơ thủ thuật tái tưới máu mạch vành.
Giới hạn điều trị: CRESTOR chưa được nghiên cứu trên bệnh nhân rối loạn lipid máu týp I và týp V theo phân loại của Fredrickson.
Cách dùng – liều dùng của thuốc Crestor 5mg
Trước khi bắt đầu điều trị, bệnh nhân phải theo chế độ ăn kiêng chuẩn giảm cholesterol và tiếp tục duy trì chế độ này trong suốt thời gian điều trị. Sử dụng các Hướng Dẫn Đồng Thuận hiện nay về điều trị rối loạn lipid để điều chỉnh liều CRESTOR cho từng bệnh nhân theo mục tiêu điều trị và đáp ứng của bệnh nhân.
CRESTOR có thể dùng bất cứ lúc nào trong ngày, trong hoặc xa bữa ăn.
Điều trị tăng cholesterol máu:
Liều khởi đầu khuyến cáo là 5mg hoặc 10mg, uống ngày 1 lần cho cả bệnh nhân chưa từng dùng thuốc nhóm statin và bệnh nhân chuyển từ dùng thuốc ức chế HMG-CoA reductase khác sang dùng CRESTOR. Việc chọn lựa liều khởi đầu nên lưu ý đến mức cholesterol của từng bệnh nhân, nguy cơ tim mạch sau này cũng như khả năng xảy ra các tác dụng không mong muốn. Hiệu chỉnh liều đến liều kế tiếp có thể thực hiện sau 4 tuần nếu cần thiết. Vì tần suất tác dụng không mong muốn tăng khi dùng liều 40mg so với các liều thấp hơn, việc chuẩn liều lần cuối đến 40mg chỉ nên được xem xét cho các bệnh nhân tăng cholesterol máu nặng có nguy cơ cao về bệnh tim mạch (đặc biệt là các bệnh nhân tăng cholesterol máu gia đình), mà không đạt được mục tiêu điều trị ở liều 20mg và các bệnh nhân này cần phải được theo dõi thường xuyên. Cần có sự theo dõi chặt chẽ của bác sỹ chuyên khoa khi bắt đầu dùng liều 40mg.
Dự phòng biến cố tim mạch:
Trong các nghiên cứu giảm nguy cơ biến cố tim mạch, liều dùng là 20mg mỗi ngày.
Trẻ em
Tăng cholesterol máu gia đình kiểu dị hợp tử trên bệnh nhi (từ 10 đến 17 tuổi):
Liều thường sử dụng của CRESTOR là 5 – 20mg/ngày, liều khuyến cáo tối đa là 20mg/ngày (liều lớn hơn 20mg chưa được nghiên cứu trên nhóm bệnh nhân này). Liều sử dụng nên được dùng theo từng cá nhân dựa trên mục tiêu điều trị được khuyến cáo (xem phần Chỉ định điều trị và Đặc tính dược lực học). Điều chỉnh liều chỉ nên thực hiện sau khoảng thời gian ≥ 4 tuần.
Tăng cholesterol máu gia đình kiểu đồng hợp tử: Kinh nghiệm sử dụng chỉ giới hạn trên một nhóm nhỏ trẻ em ( ≥ 8 tuổi).
Người cao tuổi
Nên bắt đầu với liều 5mg 1 lần 1 ngày ở người hơn 70 tuổi. Không cần điều chỉnh liều do tuổi tác.
Bệnh nhân suy thận
Không cần điều chỉnh liều ở các bệnh nhân suy thận từ nhẹ đến vừa.
Chống chỉ định dùng CRESTOR cho bệnh nhân suy thận nặng (Xem Chống Chỉ Định và Đặc tính Dược Động Học).
Bệnh nhân suy gan
Mức độ tiếp xúc với rosuvastatin tính theo nồng độ và thời gian không tăng ở những bệnh nhân có điểm số Child-Pugh ≤ 7. Tuy nhiên mức độ tiếp xúc với thuốc tăng lên đã được ghi nhận ở những bệnh nhân có điểm số Child-Pugh 8 và 9 (xem Đặc Tính Dược Động Học). Ở những bệnh nhân này nên xem xét đến việc đánh giá chức năng thận (xem Lưu Ý và Thận Trọng Khi Sử Dụng). Chưa có kinh nghiệm trên các bệnh nhân có điểm số Child-Pugh trên 9. Chống chỉ định dùng CRESTOR cho các bệnh nhân mắc bệnh gan tiến triển (xem Chống Chỉ Định).
Bệnh nhân Châu Á
Ở bệnh nhân Châu Á, cân nhắc khởi đầu với CRESTOR 5mg/lần/ngày do gia tăng nồng độ rosuvastatin huyết tương. Lưu ý đến việc tăng mức độ tiếp xúc với thuốc ở bệnh nhân Châu Á khi không kiểm soát đủ với liều trên 20mg/ngày (Xem Lưu Ý và Thận Trọng Khi Sử Dụng và Đặc Tính Dược Động học
Sử dụng trong điều trị phối hợp thuốc
Phối hợp với gemfibrozil
Khởi đầu với CRESTOR 5mg/lần/ngày. Liều dùng CRESTOR không nên vượt quá 10mg/lần/ngày (xem Lưu ý và thận trọng khi sử dụng và Tương tác thuốc).
Phối hợp với atazanavir hoặc lopinavir và ritonavir hoặc atazanavir và ritonavir
Khởi đầu với CRESTOR 5mg/lần/ngày. Liều dùng CRESTOR không nên vượt quá 10mg/lần/ngày (xem Lưu ý và thận trọng khi sử dụng và Tương tác thuốc).
Không dùng thuốc Crestor 5mg trong trường hợp sau
Flypit 10mg
Flypit 10mg là thuốc gì ?
Thuốc Flypit 10mg là thuốc...
82.500₫
Chống chỉ định dùng CRESTOR:
– Bệnh nhân quá mẫn với rosuvastatin hoặc bất kỳ tá dược nào của thuốc.
– Bệnh nhân mắc bệnh gan tiến triển kể cả tăng transaminase huyết thanh kéo dài và không rõ nguyên nhân, và khi nồng độ transaminase huyết thanh tăng hơn 3 lần giới hạn trên của mức bình thường (ULN).
– Bệnh nhân suy thận nặng (độ thanh thải creatinin < 30ml/phút).
– Bệnh nhân có bệnh lý về cơ.
– Bệnh nhân đang dùng cyclosporin.
– Phụ nữ có thai và cho con bú, phụ nữ có thể có thai mà không dùng các biện pháp tránh thai thích hợp.
Chống chỉ định dùng liều 40mg ở bệnh nhân có yếu tố nguy cơ bệnh lý cơ/tiêu cơ vân. Các yếu tố nguy cơ này bao gồm:
– Suy thận độ vừa (độ thanh thải creatinin < 60ml/phút)
– Suy giáp
– Tiền sử gia đình hoặc bản thân có bệnh lý cơ có tính di truyền.
– Tiền sử tổn thương cơ trước đây gây ra bởi thuốc ức HMG-CoA reductase khác hoặc fibrat.
– Nghiện rượu
– Các tình trạng làm tăng nồng độ thuốc trong máu.
– Bệnh nhân là người Châu Á.
– Dùng kết hợp fibrat.
Cảnh báo và thận trọng khi dùng thuốc Crestor 5mg
Ảnh hưởng trên thận
Protein niệu, được phát hiện bằng que thử và có nguồn gốc chính từ ống thận, đã được ghi nhận ở những bệnh nhân điều trị bằng CRESTOR liều cao, đặc biệt ở liều 40mg, phần lớn tình trạng này thoáng qua hoặc thỉnh thoảng xảy ra. Protein niệu không phải là dấu hiệu báo trước của tình trạng bệnh thận cấp hoặc tiến triển (xem Tác Dụng Không Mong Muốn). Cần đánh giá chức năng thận trong thời gian theo dõi các bệnh nhân đã được điều trị với liều 40mg.
Ảnh hưởng trên cơ xương
Các tác động trên cơ xương như gây ra đau cơ và bệnh cơ và một số hiếm trường hợp tiêu cơ vân đã được ghi nhận ở những bệnh nhân được điều trị bằng CRESTOR ở tất cả các liều và đặc biệt ở liều > 20mg.
Đo nồng độ creatin kinase (CK)
Không nên đo nồng độ creatin kinase (CK) sau khi vận động gắng sức hoặc khi có sự hiện diện của một nguyên nhân nào đó có thể làm tăng CK vì điều này có thể làm sai lệch kết quả. Nếu nồng độ CK tăng cao đáng kể trước khi điều trị (> 5xULN) thì nên thực hiện một xét nghiệm để xác định lại trong vòng 5 – 7 ngày. Nếu xét nghiệm lặp lại xác định nồng độ CK trước khi điều trị vẫn lớn hơn 5xULN thì không nên bắt đầu điều trị bằng CRESTOR.
Trước khi điều trị
Giống như các chất ức chế HMG-CoA reductase, CRESTOR có nguy cơ gây ra các phản ứng có hại đối với hệ cơ như teo cơ, viêm cơ, cần thận trọng khi dùng CRESTOR ở bệnh nhân có các yếu tố nguy cơ có thể dẫn đến tổn thương cơ, bệnh lý về cơ/tiêu cơ vân; xét nghiệm CK nên được tiến hành trong những trường hợp:
– Suy giảm chức năng thận
– Nhược giáp
– Tiền sử bản thân hoặc tiền sử gia đình mắc bệnh cơ di truyền
– Tiền sử bị bệnh cơ do sử dụng statin hoặc fibrat trước đó
– Tiền sử bệnh gan và/hoặc uống nhiều rượu
– Bệnh nhân cao tuổi (> 70 tuổi) có những yếu tố nguy cơ bị tiêu cơ vân
– Các tình trạng có thể gây ra tăng nồng độ thuốc trong huyết tương (xem Đặc tính Dược Động Học)
– Dùng đồng thời với các fibrat
– Khả năng xảy ra tương tác thuốc và một số đối tượng bệnh nhân đặc biệt
Trong những trường hợp này nên cân nhắc lợi ích/nguy cơ và theo dõi bệnh nhân trên lâm sàng khi điều trị bằng statin. Nếu kết quả xét nghiệm CK > 5 lần giới hạn trên của mức bình thường, không nên bắt đầu điều trị bằng statin.
Trong khi điều trị
Cần theo dõi chặt chẽ các phản ứng có hại trong quá trình dùng thuốc. Nên yêu cầu bệnh nhân báo cáo ngay cho bác sĩ các hiện tượng đau cơ, cứng cơ, yếu cơ hoặc vọp bẻ không giải thích được, đặc biệt nếu có kèm mệt mỏi, sốt, nước tiểu sẫm màu, buồn nôn hoặc nôn trong quá trình sử dụng thuốc. Khi có các biểu hiện này, bệnh nhân cần làm xét nghiệm CK để có các biện pháp can thiệp phù hợp. Nên ngưng dùng CRESTOR nếu nồng độ CK tăng cao đáng kể (> 5xULN) hoặc các triệu chứng về cơ trầm trọng và gây khó chịu hằng ngày (ngay cả khi nồng độ CK ≤ 5xULN). Nếu các triệu chứng này không còn nữa và nồng độ CK trở lại mức bình thường nên xem xét đến việc dùng lại CRESTOR hoặc dùng một chất ức chế HMG-CoA reductase khác ở liều thấp nhất và theo dõi chặt chẽ.
Việc theo dõi định kỳ nồng độ CK ở các bệnh nhân không có triệu chứng không đảm bảo phát hiện bệnh cơ.
Tăng nguy cơ tổn thương cơ khi sử dụng statin đồng thời với các thuốc sau: Gemfibrozil, các thuốc hạ cholesterol máu nhóm fibrat khác, niacin liều cao (> 1g/ngày), colchicin.
Trong các thử nghiệm lâm sàng, không ghi nhận thấy sự gia tăng ảnh hưởng trên cơ xương ở một số ít bệnh nhân dùng CRESTOR đồng thời với các thuốc khác. Tuy nhiên, tỷ lệ mắc bệnh viêm cơ và bệnh cơ gia tăng đã được thấy ở bệnh nhân dùng các chất ức chế HMG-CoA reductase khác đồng thời với các dẫn xuất của acid fibric kể cả gemfibrozil, cyclosporin, acid nicotinic, thuốc kháng nấm nhóm azole, các chất ức chế protease và kháng sinh nhóm macrolid. Gemfibrozil làm tăng nguy cơ bệnh cơ khi dùng đồng thời với vài chất ức chế HMG-CoA reductase. Do vậy, sự phối hợp giữa CRESTOR và gemfibrozil không được khuyến cáo. Việc sử dụng kết hợp CRESTOR với fibrat hoặc niacin để đạt được sự thay đổi hơn nữa nồng độ lipid nên được cân nhắc kỹ giữa lợi ích và nguy cơ có thể xảy ra do những kết hợp này (xem Tương Tác Thuốc và Tác Dụng Không Mong Muốn).
Không nên dùng CRESTOR cho bệnh nhân có tình trạng nghiêm trọng cấp tính, nghi ngờ do bệnh cơ hoặc có thể dẫn đến suy thận thứ phát do tiêu cơ vân (như nhiễm khuẩn huyết, tụt huyết áp, đại phẫu, chấn thương, rối loạn điện giải, nội tiết và chuyển hóa nặng; hoặc co giật không kiểm soát được).
Ảnh hưởng trên gan
Giống như các chất ức chế HMG-CoA reductase khác, cần thận trọng khi dùng CRESTOR ở bệnh nhân nghiện rượu nặng và/hoặc có tiền sử bệnh gan.
Các thử nghiệm chức năng gan được khuyến cáo thực hiện trước khi điều trị và 3 tháng sau khi bắt đầu điều trị bằng CRESTOR. Nên ngưng hoặc giảm liều CRESTOR nếu nồng độ transaminase huyết thanh gấp 3 lần giới hạn trên của mức bình thường.
Ở những bệnh nhân tăng cholesterol thứ phát do thiểu năng tuyến giáp hoặc hội chứng thận hư, thì những bệnh này phải được điều trị trước khi bắt đầu dùng CRESTOR.
Chủng tộc
Các nghiên cứu dược động học cho thấy có sự gia tăng mức độ tiếp xúc với thuốc tính theo nồng độ và thời gian ở bệnh nhân Châu Á so với người da trắng (xem Liều Lượng và Cách Sử Dụng và Đặc Tính Dược Động Học).
Tác động trên hệ nội tiết
Tăng HbA1c và nồng độ glucose huyết lúc đói đã được ghi nhận khi dùng các chất ức chế HMG-CoA reductase, bao gồm cả CRESTOR. Dựa trên dữ liệu nghiên cứu lâm sàng của CRESTOR, trong một số trường hợp sự gia tăng này có thể vượt ngưỡng để xác định bệnh đái tháo đường (xem Tác dụng ngoại ý).
Các chất ức chế protease
Việc sử dụng đồng thời các thuốc hạ lipid máu nhóm statin với các thuốc ức chế protease điều trị HIV và viêm gan siêu vi C (HCV) có thể làm tăng nguy cơ gây tổn thương cơ, nghiêm trọng nhất là tiêu cơ vân. Tình trạng tổn thương thận là hậu quả của tiêu cơ vân, có thể dẫn đến suy thận và gây tử vong. Không khuyến cáo dùng chung với các chất ức chế protease (xem phần Tương tác thuốc)
Không dung nạp lactose
Bệnh nhân có vấn đề về di truyền hiếm gặp không dung nạp galactose, thiếu hụt Lapp lactase hoặc kém hấp thu glucose-galactose không nên dùng thuốc này.
Sử dụng trên bệnh nhi
Tính an toàn và hiệu quả của CRESTOR trên các bệnh nhân từ 10 đến 17 tuổi bị tăng cholesterol máu gia đình kiểu dị hợp tử được đánh giá trong thử nghiệm lâm sàng có đối chứng kéo dài 12 tuần, tiếp theo là giai đoạn nhãn mở 40 tuần. Bệnh nhân được điều trị bằng CRESTOR 5mg, 10mg và 20mg mỗi ngày có dữ liệu về các tác dụng ngoại ý nói chung tương tự như nhóm dùng giả dược (xem phần Tác dụng ngoại ý). Mặc dù không phải tất cả các phản ứng ngoại ý quan sát được ở nhóm bệnh nhân trưởng thành đều được ghi nhận trong các thử nghiệm lâm sàng ở trẻ em và thanh thiếu niên nhưng các lưu ý và thận trọng cân nhắc ở trẻ em và thanh thiếu niên nên tương tự như ở người lớn. Không tìm thấy ảnh hưởng nào của CRESTOR trên sự tăng trưởng, thể trọng, chỉ số khối cơ thể hoặc sự hoàn thiện hệ sinh dục (xem phần Tác dụng ngoại ý) ở các bệnh nhi (từ 10 đến 17 tuổi). Các bệnh nhân thiếu niên nữ nên được sử dụng biện pháp tránh thai thích hợp trong thời gian điều trị bằng CRESTOR (xem phần Đặc tính dược động học, Các nhóm bệnh nhân đặc biệt). CRESTOR chưa được nghiên cứu trong các thử nghiệm lâm sàng có đối chứng liên quan đến các bệnh nhân chưa dậy thì hoặc các bệnh nhân nhỏ hơn 10 tuổi. Liều sử dụng CRESTOR lớn hơn 20mg chưa được nghiên cứu ở các bệnh nhi.
Nghiên cứu về các bệnh nhi và thanh thiếu niên bị tăng cholesterol máu gia đình kiểu đồng hợp tử chỉ giới hạn trên 8 bệnh nhân ( >= 8 tuổi).
Tác dụng không mong muốn khi dùng thuốc Crestor 5mg
Các biến cố không mong muốn được ghi nhận khi dùng CRESTOR thường nhẹ và thoáng qua. Trong các nghiên cứu lâm sàng có đối chứng, có dưới 4% bệnh nhân điều trị bằng CRESTOR rút khỏi nghiên cứu do biến cố không mong muốn.
Tần suất của các biến cố không mong muốn như sau: Thường gặp (> 1/100, < 1/10), ít gặp (> 1/1000, < 1/100), hiếm gặp (> 1/10.000, < 1/1000), rất hiếm gặp (< 1/10.000).
Rối loạn hệ miễn dịch Hiếm gặp: Các phản ứng quá mẫn kể cả phù mạch.
Rối loạn hệ nội tiết: Thường gặp: Đái tháo đường(*).
Rối loạn tâm thần: Tần số không rõ: Trầm cảm.
Rối loạn hệ thần kinh Thường gặp: Nhức đầu, chóng mặt. Rất hiếm gặp: Bệnh đa dây thần kinh, giảm trí nhớ. Không rõ tần số: Bệnh lý thần kinh ngoại biên, rối loạn giấc ngủ (bao gồm mất ngủ, ác mộng), suy giảm nhận thức.
Rối loạn hô hấp, lồng ngực và trung thất: Tần số không rõ: Ho, khó thở
Rối loạn hệ tiêu hoá Thường gặp: Táo bón, buồn nôn, đau bụng. Hiếm gặp: Viêm tụy. Tần số không rõ: Tiêu chảy.
Rối loạn da và mô dưới da Ít gặp: Ngứa, phát ban và mề đay. Tần số không rõ: Hội chứng Steven-Johnsons.
Rối loạn hệ cơ xương, mô liên kết và xương
Thường gặp: Đau cơ. Hiếm gặp: Bệnh cơ, tiêu cơ vân. Rất hiếm gặp: Đau khớp. Tần số không rõ: Tổn thương gân, bệnh lý hoại tử cơ qua trung gian miễn dịch.
Các rối loạn tổng quát: Thường gặp: Suy nhược.
(*) Theo ghi nhận trong nghiên cứu JUPITER (báo cáo tần số tổng quát là 2,8% ở nhóm dùng rosuvastatin và 2,3% ở nhóm giả dược) chủ yếu xảy ra ở bệnh nhân đã sẵn có nguy cơ cao tiến triển bệnh đái tháo đường (xem phần Lưu ý và thận trọng khi sử dụng).
Giống như các chất ức chế HMG-CoA reductase khác, tần suất xảy ra tác dụng không mong muốn liên quan đến thuốc có khuynh hướng phụ thuộc liều sử dụng.
Tác động trên thận: Protein niệu, được phát hiện bằng que thử và có nguồn gốc chính từ ống thận, đã được ghi nhận ở những bệnh nhân điều trị bằng Crestor. Sự thay đổi lượng protein niệu từ không có hoặc chỉ có vết đến dương tính ++ hoặc cao hơn đã được nhận thấy ở < 1% bệnh nhân khi điều trị bằng CRESTOR 10mg và 20mg và khoảng 3% bệnh nhân khi điều trị bằng CRESTOR 40mg. Lượng protein niệu tăng nhẹ từ không có hoặc có vết đến dương tính + được ghi nhận ở liều 20mg. Trong hầu hết các trường hợp, protein niệu giảm hoặc tự biến mất khi tiếp tục điều trị và không phải là dấu hiệu báo trước của bệnh thận cấp tính hay tiến triển.
Tác động trên hệ cơ-xương: Tác động trên hệ cơ-xương như đau cơ, bệnh cơ và một số hiếm trường hợp tiêu cơ vân đã được ghi nhận ở những bệnh nhân được điều trị bằng Crestor ở tất cả các liều và đặc biệt ở liều > 20mg.
Tăng nồng độ CK theo liều dùng được quan sát thấy ở bệnh nhân dùng rosuvastatin; phần lớn các trường hợp nhẹ, không có triệu chứng và thoáng qua. Nếu nồng độ CK tăng (> 5xULN), việc điều trị nên ngưng tạm thời (xem Lưu Ý và Thận Trọng Khi Sử Dụng).
Tác động trên gan: Cũng giống như các chất ức chế HMG-CoA reductase khác, tăng transaminase theo liều đã được ghi nhận ở một số ít bệnh nhân dùng rosuvastatin; phần lớn các trường hợp đều nhẹ, không có triệu chứng và thoáng qua.
Trong nghiên cứu JUPITER, 17.802 bệnh nhân được điều trị bằng rosuvastatin 20mg (n=8901) hoặc giả dược (n=8901) trong thời gian trung bình 2 năm. Tỉ lệ phần trăm bệnh nhân ngưng điều trị vì tác dụng ngoại ý (không xét đến quan hệ nhân quả với trị liệu) ở nhóm dùng rosuvastatin cao hơn so với nhóm giả dược, tương ứng là 6,6% so với 6,2%. Đau cơ là tác dụng ngoại ý thường gặp nhất dẫn đến việc ngưng điều trị.
Trong nghiên cứu JUPITER, tần suất bệnh đái tháo đường ở nhóm bệnh nhân dùng rosuvastatin là 2,8% cao hơn có ý nghĩa thống kê so với nhóm bệnh nhân dùng giả dược 2,3%. Mức HbA1c trung bình tăng cao hơn có ý nghĩa thống kê đến 0,1% ở nhóm điều trị bằng rosuvastatin so với nhóm giả dược. Số lượng bệnh nhân có HbA1c > 6,5% vào cuối đợt thử nghiệm ở nhóm dùng rosuvastatin cao hơn có ý nghĩa thống kê so với nhóm giả dược (xem phần Lưu ý đặc biệt và thận trọng khi sử dụng và Đặc tính dược lực học).
Các phản ứng ngoại ý ghi nhận được > 2% ở các bệnh nhân và các tỉ lệ này cao hơn so với nhóm giả dược được trình bày ở Bảng 1.
Bảng 1: Các phản ứng ngoại ý* được ghi nhận ≥ 2% bệnh nhân dùng CRESTOR và > nhóm giả dược trong nghiên cứu JUPITER (tính theo % số bệnh nhân)
| Phản ứng ngoại ý |
CRESTOR 20mg N=8901 |
Giả dược N=8901 |
| Đau cơ |
7,6 |
6,6 |
| Đau khớp |
3,8 |
3,2 |
| Táo bón |
3,3 |
3,0 |
| Đái tháo đường |
2,8 |
2,3 |
| Buồn nôn |
2,4 |
2,3 |
*Các phản ứng ngoại ý cần xử trí khẩn theo định danh của MedDRA.
Bệnh nhi từ 10 đến 17 tuổi:
Trong nghiên cứu có đối chứng 12 tuần ở các bệnh nhi nam và bệnh nhi nữ đã có kinh nguyệt, dữ liệu về tính an toàn và khả năng dung nạp khi dùng CRESTOR 5mg đến 20mg mỗi ngày nhìn chung tương tự với nhóm giả dược (xem phần Đặc tính dược lực học và phần Đặc tính dược động học, Các nhóm bệnh nhân đặc biệt).
Tuy nhiên, sự tăng creatin phosphokinase (CK) huyết thanh > 10 x ULN được ghi nhận nhiều hơn ở nhóm bệnh nhi dùng rosuvastatin so với nhóm giả dược. 4 trường hợp trong 130 (3%) bệnh nhi điều trị bằng rosuvastatin (2 bệnh nhân dùng liều 10mg, 2 bệnh nhân dùng liều 20mg) bị tăng CK > 10 x ULN so với không có trường hợp nào trong số 46 bệnh nhi dùng giả dược.
Kinh nghiệm trong quá trình lưu hành thuốc:
Ngoài các phản ứng đề cập ở trên, các biến cố không mong muốn sau cũng được ghi nhận trong quá trình lưu hành thuốc Crestor:
Rối loạn huyết học: Tần xuất chưa biết: Giảm tiểu cầu
Rối loạn hệ gan-mật: Rất hiếm gặp: Vàng da, viêm gan; hiếm gặp: Tăng men gan.
Rối loạn hệ sinh sản và tuyến vú: Tần xuất chưa biết: Nữ hoá tuyến vú
Tương tác thuốc và các dạng tương tác khác
Cyclosporin
Trong quá trình điều trị đồng thời Crestor với cyclosporin,giá trị AUC của rosuvastatin trung bình cao hơn 7 lần so với ở người tình nguyện khỏe mạnh. Crestor được chống chỉ định ở những bệnh nhân đang dùng cyclosporin. Dùng đồng thời không ảnh hưởng đến nồng độ trong huyết tương của cyclosporin.
Gemfibrozil
Gemfibrozil làm tăng đáng kể nồng độ và thời gian tiếp xúc của rosuvastatin. Do nguy cơ tăng bệnh lý cơ/tiêu cơ vân đã đượcghi nhận, nên tránh phối hợp CRESTOR với gemfibrozil. Nếu phải sử dụng cùng lúc thì liều dùng CRESTOR không nên vượt quá 10mg, 1 lần/ngày.
Thuốc ức chế protease
Dùng đồng thời rosuvastatin với một số thuốc ức chế protease phối hợp với ritonavir sẽ có tác động khác nhau lên nồng độ và thời gian tiếp xúc của rosuvastatin. Phối hợp thuốc ức chế protease lopinavir/ritonavir và atazanavir/ritonavir làm tăng nồng độ và thời gian tiếp xúc của rosuvastatin (AUC) gấp 3 lần. Khi sử dụng cùng với các kết hợp thuốc này, liều CRESTOR không nên vượt quá 10mg, 1 lần/ngày. Sự kết hợp của tipranavir/ ritonavir hoặc fosamprenavir/ ritonavir làm thay đổi ít hay không thay đổi nồng độ và thời gian tiếp xúc của rosuvastatin. Cần thận trọng khi dùng đồng thời rosuvastatin với các thuốc ức chế protease được dùng phối hợp với ritonavir (xem Liều lượng và Cách Sử Dụng, Lưu ý và Thận Trọng Khi Sử Dụng).
Thuốc chống đông Coumarin
CRESTOR làm tăng đáng kể chỉ số INR ở bệnh nhân dùng thuốc chống đông coumarin. Vì thế, nên thận trọng khi dùng đồng thời thuốc chống đông coumarin đồng thời với CRESTOR. Ở bệnh nhân dùng đồng thời thuốc chống đông coumarin và CRESTOR, nên xác định INR trước khi bắt đầu dùng CRESTOR và định kỳ kiểm tra trong giai đoạn sớm của quá trình điều trị để đảm bảo chỉ số INR không bị thay đổi đáng kể (xem Lưu Ý và Thận Trọng Khi Sử Dụng).
Niacin
Nguy cơ tác động lên hệ cơ xương có thể gia tăng khi sử dụng CRESTOR phối hợp với niacin ở liều thay đổi lipid ( >= 1g/ngày); nên thận trọng khi kê đơn với CRESTOR (xem Lưu Ý và Thận Trọng Khi Sử Dụng).
Fenofibrat
Khi sử dụng đồng thời CRESTOR với fenofibrat, không có ghi nhận sự gia tăng AUC của rosuvastatin hay fenofibrat có ý nghĩa lâm sàng. Vì đã biết trong quá trình điều trị với chất ức chế HMG-CoA reductase, nguy cơ bệnh lý cơ gia tăng khi dùng đồng thời với fenofibrat, nên thận trọng khi kê đơn fenofibrat với CRESTOR (xem Lưu Ý và Thận Trọng Khi Sử Dụng).
Colchicin
Các trường hợp tổn thương cơ, kể cả tiêu cơ vân, đã được ghi nhận khi dùng các chất ức chế HMG-CoA reductase, bao gồm rosuvastatin, đồng thời với colchicin, nên thận trọng khi sử dụng CRESTOR với colchicin (xem Lưu ý và Thận Trọng Khi Sử Dụng).
Các nhựa gắn acid mật có thể làm giảm rõ rệt khả dụng sinh học của statin khi uống cùng. Vì vậy thời gian dùng 2 thuốc này phải cách xa nhau. Mặc dù không tiến hành các nghiên cứu về tương tác thuốc trong lâm sàng, nhưng không thấy có biểu hiện tương tác có hại có ý nghĩa lâm sàng khi dùng statin cùng với các chất ức chế enzym chuyển angiotensin, các thuốc chẹn beta, chẹn kênh calci, thuốc lợi tiểu và thuốc chống viêm không steroid.
Ezetimib:
Sử dụng đồng thời 10mg Crestor và 10mg ezetimibe dẫn đến gia tăng gấp 1,2 giá trị AUC của rosuvastatin ở bệnh nhân tăng cholesterol máu. Không thể loại trừ tương tác dược lực, về mặt tác dụng ngoại ý, giữa Crestor và ezetimibe.
Thuốc kháng acid:
Dùng đồng thời Crestor với hỗn dịch kháng acid có chứa nhôm và magnesi hydroxyd dẫn đến giảm nồng độ rosuvastatin trong huyết tương khoảng 50%. Tác động này đã được giảm nhẹ khi các thuốc kháng acid được dùng sau khi uống Crestor khoảng 2 giờ. Sự liên quan lâm sàng của tương tác này chưa được nghiên cứu.
Erythromycin:
Sử dụng đồng thời Crestor và erythromycin dẫn đến giảm 20% giá trị AUC và giảm 30% giá trị Cmax của rosuvastatin. Nguyên nhân của sự tương tác này có thể do sự gia tăng nhu động ruột gây ra bởi erythromycin.
Thuốc chuyển hóa qua enzym Cytochrom P450:
Kết quả từ các nghiên cứu in vitro và in vivo cho thấy rosuvastatin không phải là một chất ức chế hay chất cảm ứng enzym cytochrom P450. Ngoài ra, rosuvastatin là một cơ chất yếu cho các isoenzym này.
Do đó, dự kiến không có tương tác thuốc do chuyển hóa trung gian qua cytochrom P450. Cũng không ghi nhận có tương tác liên quan trên lâm sàng giữa rosuvastatin với fluconazol (chất ức chế CYP2C9 và CYP3A4) hoặc với ketoconazol (chất ức chế CYP2A6 và CYP3A4).
Liệu pháp thay thế hormon/thuốc tránh thai đang uống (HRT):
Sử dụng đồng thời Crestor và thuốc tránh thai dạng uống dẫn đến sự gia tăng ethinyl estradiol và norgestrel AUC tương ứng là 26% và 34%. Nồng độ thuốc trong huyết tương gia tăng nên được xem xét khi lựa chọn liều thuốc tránh thai dạng uống. Không có dữ liệu dược động học ở các đối tượng dùng đồng thời Crestor và HRT và do đó không thể được loại trừ tác động tương tự. Tuy nhiên, sự kết hợp đã được sử dụng rộng rãi ở phụ nữ trong các thử nghiệm lâm sàng và được dung nạp tốt.
Sử dụng ở phụ nữ có thai và cho con bú
Crestor chống chỉ định trên phụ nữ có thai và cho con bú.
Phụ nữ có thể mang thai nên sử dụng các biện pháp ngừa thai thích hợp.
Vì cholesterol và các sản phẩm sinh tổng hợp cholesterol khác là cần thiết cho sự phát triển bào thai, nên nguy cơ tiềm tàng do ức chế HMG-CoA reductase sẽ chiếm ưu thế hơn lợi ích của việc điều trị bằng Crestor trong suốt thờigian mang thai. Các nghiên cứu trên động vật cho thấy có những bằng chứng giới hạn về độc tính trên hệ sinh sản (xem Dữ Liệu An Toàn Tiền Lâm Sàng). Nếu bệnh nhân có thai trong khi điều trị bằng Crestor thì nên ngưng thuốc ngay lập tức.
Ở chuột, rosuvastatin bài tiết qua sữa. Không có dữ liệu tương ứng về sự bài tiết qua sữa ở người (xem Chống Chỉ Định).
Ảnh hưởng của thuốc tới khả năng lái xe và vận hành máy móc
Các nghiên cứu để xác định ảnh hưởng của CRESTOR trên khả năng lái xe và vận hành máy chưa được thực hiện. Tuy nhiên, dựa trên những đặc tính dược lực thì CRESTOR không thể ảnh hưởng trên các khả năng này. Khi lái xe hoặc vận hành máy nên lưu ý rằng chóng mặt có thể xảy ra trong thời gian điều trị.
Quá liều và cách xử trí
Không có phương pháp điều trị đặc hiệu khi dùng thuốc qua liều. Khi quá liều, bệnh nhân nên được điều trị triệu chứng và áp dụng các biện pháp hỗ trợ khi cần thiết. Nên theo dõi chức năng gan và nồng độ CK. Việc thẩm phân máu có thể không có lợi.
Hạn dùng và bảo quản Crestor 5mg
Không bảo quản trên 30°C. Bảo quản trong bao bì gốc.
Hạn dùng 2 năm kể từ ngày sản xuất.
Nguồn gốc, xuất xứ Crestor 5mg
NHÀ SẢN XUẤT iPR Pharmaceuticals, Inc., Carr 188 Lote 17. San Isidro Industrial Park, Po Box 1624, Canovanas, PR 00729, Puerto Rico, Hoa Ky.
NHÀ ĐÓNG GÓI AstraZeneca UK Limited, Silk Road Business Park, Macclesfield, Cheshire, SK10 2NA, Anh.
Ngày hiệu đính toa thuốc: 05/09/2016
Dược lực học
Cơ chế tác động
Rosuvastatin là một chất ức chế chọn lọc và cạnh tranh với HMG-CoA reductase, là enzym xúc tác quá trình chuyển đổi 3-hydroxy-3-methylglutaryl coenzym A thành mevalonat, một tiền chất của cholesterol. Vị trí tác động chính của rosuvastatin là gan, cơ quan đích làm giảm cholesterol.
Rosuvastatin làm tăng số lượng thụ thể LDL trên bề mặt tế bào ở gan, do vậy làm tăng hấp thu và dị hóa LDL và ức chế sự tổng hợp VLDL ở gan, vì vậy làm giảm các thành phần VLDL và LDL.
Tác động dược lực
CRESTOR làm giảm sự tăng nồng độ LDL-cholesterol, cholesterol toàn phần và triglyceride và làm tăng HDL-cholesterol. Thuốc cũng làm giảm ApoB, non HDL-C, VLDL-C, VLDL-TG và làm tăng ApoA-l (xem bảng 1 và 2). CRESTOR cũng làm giảm các tỷ lệ LDL-C/HDL-C, C toàn phần/HDL-C, non HDL-C/HDL-C và ApoB/ApoA-l.
Bảng 2: Đáp ứng theo liều ở bệnh nhân tăng cholesterol máu nguyên phát (Loại IIa và IIb) (mức thay đổi trung bình (%) so với trước khi điều trị)
| Liều |
Số bệnh nhân |
LDL-C |
C toàn phần |
HDL-C |
TG |
NonHDL-C |
ApoB |
ApoA-I |
| Giả dược |
13 |
-7 |
-5 |
3 |
-3 |
-7 |
-3 |
0 |
| 5 |
17 |
-45 |
-33 |
13 |
-35 |
-44 |
-38 |
4 |
| 10 |
17 |
-52 |
-36 |
14 |
-10 |
-48 |
-42 |
4 |
| 20 |
17 |
-55 |
-40 |
8 |
-23 |
-51 |
-46 |
5 |
| 40 |
18 |
-63 |
-46 |
10 |
-28 |
-60 |
-54 |
0 |
Bảng 3: Đáp ứng theo liều ở bệnh nhân bị tăng triglyceride (Týp IIb hoặc týp IV) (% thay đổi bình quân so với ban đầu)
| Liều |
N |
TG |
LDL-C |
C-Toàn phần |
HDL-C |
NonHDL-C |
VLDL-C |
VLDL-TG |
| Giả dược |
26 |
1 |
5 |
1 |
-3 |
2 |
2 |
6 |
| 5 |
25 |
-21 |
-28 |
-24 |
3 |
-29 |
-25 |
-24 |
| 10 |
23 |
-37 |
-45 |
-40 |
8 |
-49 |
-48 |
-39 |
| 20 |
27 |
-37 |
-31 |
-34 |
22 |
-43 |
-49 |
-40 |
| 40 |
25 |
-43 |
-43 |
-40 |
17 |
-51 |
-56 |
-48 |
Hiệu quả trị liệu đạt được trong vòng 1 tuần sau khi bắt đầu điều trị và 90% đáp ứng tối ưu đạt được trong 2 tuần. Đáp ứng tối ưu thường đạt được vào khoảng 4 tuần và được duy trì sau đó.
Hiệu quả lâm sàng
CRESTOR được chứng minh có hiệu quả ở nhóm bệnh nhân người lớn tăng cholesterol máu, có hay không có tăng triglycerid máu, bất kỳ chủng tộc, giới tính hay tuổi tác và ở những nhóm bệnh nhân đặc biệt như đái tháo đường hoặc bệnh nhân tăng cholesterol máu gia đình.
Từ các dữ liệu nghiên cứu pha III, CRESTOR chứng tỏ có hiệu quả trong điều trị ở hầu hết các bệnh nhân tăng cholesterol máu loại IIa và IIb (LDL-C trung bình trước khi điều trị khoảng 4,8mmol/l) theo các mục tiêu điều trị của Hội Xơ Vữa Mạch Máu Châu Âu (European Atherosclerosis Society – EAS; 1998); khoảng 80% bệnh nhân được điều trị bằng CRESTOR 10mg đã đạt được các mục tiêu điều trị của EAS về nồng độ LDL-C (< 3mmol/l).
Trong 1 nghiên cứu lớn, 435 bệnh nhân tăng cholesterol máu di truyền gia đình kiểu dị hợp tử đã được cho dùng CRESTOR từ 20 – 80mg theo thiết kế điều chỉnh tăng liều. Người ta thấy là tất cả các liều CRESTOR đều có tác động có lợi trên các thông số lipid và đạt được các mục tiêu điều trị. Sau khi chỉnh đến liều hằng ngày 40mg (12 tuần điều trị) LDL-C giảm 53%. 33% bệnh nhân đạt được các mục tiêu của EAS về nồng độ LDL-C (< 3mmol/l).
Trong một nghiên cứu mở, điều chỉnh liều tăng dần, 42 bệnh nhân tăng cholesterol máu di truyền kiểu đồng hợp tử được đánh giá về đáp ứng điều trị với liều CRESTOR 20 – 40mg. Tất cả bệnh nhân nghiên cứu đều có độ giảm trung bình LDL-C là 22%.
Trong các nghiên cứu lâm sàng với một số lượng bệnh nhân nhất định, CRESTOR chứng tỏ có hiệu quả phụ trợ trong việc làm giảm triglyceride khi được sử dụng phối hợp với fenofibrat và làm tăng nồng độ HDL-C khi sử dụng phối hợp với niacin (xem Lưu Ý và Thận Trọng Khi Sử Dụng).
Rosuvastatin chưa được chứng minh là có thể ngăn chặn các biến chứng có liên quan đến sự bất thường về lipid như bệnh mạch vành vì các nghiên cứu về giảm tỷ lệ tử vong và giảm tỷ lệ bệnh lý khi dùng CRESTOR đang được thực hiện.
Đánh giá tác dụng trên độ dày lớp nội trung mạc: Nghiên cứu đánh giá rosuvastatin 40mg (METEOR), hiệu quả điều trị của CRESTOR trên xơ vữa động mạch cảnh được đánh giá bằng siêu âm 2 chiều (B-mode) ở những bệnh nhân bị tăng LDL-C, có nguy cơ bệnh động mạch vành thấp (thang điểm nguy cơ Framingham < 10% trong 10 năm) và xơ vữa động mạch dưới lâm sàng có dày lớp nội trung mạc động mạch cảnh (cIMT). Trong nghiên cứu lâm sàng mù đôi, đối chứng với giả dược, 984 bệnh nhân được điều trị ngẫu nhiên (trong đó có 876 người đã được phân tích), bằng CRESTOR 40mg hoặc giả dược 1 lần/ngày với tỉ lệ là 5:2. Siêu âm thành động mạch cảnh được sử dụng để xác định tỉ lệ thay đổi trung bình lớp nội trung mạc dày nhất hàng năm ở 12 điểm đo trên mỗi bệnh nhân so với ban đầu trong 2 năm. Sự khác biệt về tỉ lệ thay đổi lớp nội trung mạc dày nhất của tất cả 12 vị trí động mạch cảnh giữa bệnh nhân điều trị bằng CRESTOR và bệnh nhân dùng giả dược là -0,0145mm/năm (95% Cl -0,0196, -0,0093; p < 0,0001).
Tỉ lệ thay đổi hàng năm so với trước khi điều trị của nhóm dùng giả dược là +0,0131mm/năm (p < 0,0001). Tỷ lệ thay đổi hàng năm so với trước khi điều trị ở nhóm CRESTOR là -0,0014mm/năm (p = 0,32).
Ở từng bệnh nhân trong nhóm dùng CRESTOR, 52,1% bệnh nhân chứng tỏ không có sự tiến triển bệnh (được định nghĩa là tỉ lệ thay đổi có giá trị âm hàng năm), so với 37,7% bệnh nhân ở nhóm dùng giả dược.
Rối loạn bêta lipoprotein máu nguyên phát (tăng lipoprotein máu týp III)
Trong nghiên cứu chéo, mù đôi, đa trung tâm, ngẫu nhiên, có 32 bệnh nhân (27 người có đột biến ε2/ε2 và 4 người có đột biến apo E [Arg145Cys] bị rối loạn beta lipoprotein máu nguyên phát (tăng lipoprotein máu týp III) tham gia được khởi đầu bằng chế độ ăn kiêng trong 6 tuần theo Điều trị thay đổi lối sống (TLC) của NCEP. Sau giai đoạn 6 tuần ăn kiêng, bệnh nhân được ngẫu nhiên điều trị phối hợp với chế độ ăn kiêng trong 6 tuần bằng liệu pháp rosuvastatin 10mg tiếp theo là rosuvastatin 20mg, hoặc rosuvastatin 20mg tiếp theo là rosuvastatin 10mg. CRESTOR làm giảm cholesterol không phải HDL (thông số nghiên cứu chính) và nồng độ lipoprotein còn lại trong tuần hoàn. Kết quả được trình bày trong bảng bên dưới.
Bảng 4: Các tác động thay đổi lipid máu của rosuvastatin 10mg và 20mg trong bệnh rối loạn beta lipoprotein máu nguyên phát (tăng lipoprotein máu týp III) sau 6 tuần điều trị được thể hiện bằng trung vị phần tram thay đổi (95% Cl) so với giá trị ban đầu (N=32)
| Giá trị trung vị ban đầu (mg/dL) |
Trung vị phần tram thay đổi so với giá trị ban đầu (95% Cl) CRESTOR 10mg |
Trung vị phần tram thay đổi so với giá trị ban đầu (95% Cl) CRESTOR 20mg |
| Cholesterol toàn phần |
342,5 |
-43,3
(-46,9;-37,5)
|
-47,6
(-51,6;-42,8)
|
| Triglycerides |
503,5 |
-40,1
(-44,9; -33,6)
|
-43,0
(-52,5;-33,1)
|
| Non-HDL-C |
294,5 |
-48,2
(-56,7; -45,6)
|
-56,4
(-61,4;-48,5)
|
| VLDL-C+IDL-C |
209,5 |
-46.8
(-53,7; -39,4)
|
-56,2
(-67,7;-43,7)
|
| LDL-C |
112,5 |
-54,4
(-59,1;-47,3)
|
-57,3
(-59,4;-52,1)
|
| HDL-C |
35,5 |
10,2
(1,9; 12,3)
|
11,2
(8,3; 20,5)
|
| RLP-C |
82,0 |
-56,4
(-67,1;-49,0)
|
-64,9
(-74,0; -56,6)
|
| Apo-E |
16,0 |
-42,9
(-46,3; -33,3)
|
-42,5
(-47,1;-35,6)
|
Bệnh nhi tăng cholesterol máu gia đình kiểu dị hợp tử
Trong 1 nghiên cứu 12 tuần, đối chứng với giả dược, đa trung tâm, ngẫu nhiên, mù đôi, 176 bệnh nhi và thiếu niên (97 nam và 79 nữ) bị tăng cholesterol máu gia đình kiểu dị hợp tử được điều trị ngẫu nhiên bằng rosuvastatin 5mg, 10mg, 20mg hoặc giả dược hằng ngày. Các bệnh nhân có độ tuổi từ 10 đến 17 tuổi (tuổi trung vị là 14 tuổi) với khoảng 30% bệnh nhân từ 10 đến 13 tuổi và khoảng 17%, 18%, 40%, 25% bệnh nhân dậy thì tương ứng theo phân loại Tanner độ II, III, IV và V. Các bệnh nhi nữ phải có kinh nguyệt ít nhất 1 năm. Mức LDL-C trung bình tại thời điểm ban đầu là 233mg/dL (trong khoảng 129 đến 399mg/dL). Tiếp theo sau nghiên cứu mù đôi 12 tuần là 1 pha điều chỉnh liều nhãn mở 40 tuần, trong đó các bệnh nhân được dùng rosuvastatin hằng ngày với liều 5mg, 10mg, 20mg.
Rosuvastatin làm giảm đáng kể LDL-C (thông số nghiên cứu chính), cholesterol toàn phần và nồng độ apoB ở mỗi mức liều khi so với nhóm giả dược. Kết quả được trình bày ở bảng 5 bên dưới.
Bảng 5: Tác động thay đổi lipid của rosuvastatin ở những bệnh nhi từ 10 đến 17 tuổi bị tăng cholesterol máu gia đình kiểu dị hợp tử (bình phương nhỏ nhất của trung bình % thay đổi giữa giá trị ban đầu và giá trị ở tuần 12)
| Liều (mg) |
N |
LDL-C |
HDL-C |
C-toàn phần |
TGa |
ApoB |
| Giả dược |
46 |
-1% |
+7% |
0% |
-7% |
-2% |
| 5 |
42 |
-38% |
+4%b |
-30% |
-13%b |
-32% |
| 10 |
44 |
-45 |
+ 11 %b |
-34% |
-15%b |
-38% |
| 20 |
44 |
-50% |
+9%b |
-39% |
-16%b |
-41% |
a % thay đổi trung vị
b Sự khác biệt so với giả dược không có ý nghĩa về mặt thống kê
Ở tuần thứ 12 của giai đoạn điều trị mù đôi, tỉ lệ % bệnh nhân đạt được LDL-C mục tiêu < 110mg/dL (2,8 mmol/l) là 0% ở nhóm giả dược, 12% ở nhóm dùng rosuvastatin 5mg, 41% ở nhóm dùng rosuvastatin 10mg, 41% ở nhóm dùng rosuvastatin 20mg. Trong giai đoạn nghiên cứu 40 tuần, nhãn mở, 71% bệnh nhân được điều chỉnh đến liều cao nhất 20mg và 41% bệnh nhân đạt được LDL-C mục tiêu là 110mg/dL.
Hiệu quả dài hạn của rosuvastatin khi bắt đầu điều trị từ tuổi thiếu niên để làm giảm tỉ lệ bệnh và tỉ lệ tử vong lúc trưởng thành chưa được thiết lập.
Phòng ngừa bệnh tim mạch nguyên phát
Thử nghiệm lâm sàng can thiệp đánh giá rosuvastatin trong phòng ngừa tiên phát (nghiên cứu JUPITER), hiệu quả của CRESTOR (rosuvastatin calcium) trên tần xuất các biến cố tim mạch lớn được đánh giá trên 17.802 nam ( >= 50 tuổi) và nữ ( >= 60 tuổi) là những người chưa có bằng chứng lâm sàng về bệnh tim mạch, nồng độ LDL-C < 130mg/dL (3,3mmol/l) và nồng độ hs-CRP >= 2mg/l. Khi bắt đầu nghiên cứu, quần thể nghiên cứu có nguy cơ bệnh mạch vành ước lượng là 11,6% trong 10 năm dựa trên tiêu chuẩn thang điểm nguy cơ Framingham và bao gồm tỷ lệ cao các bệnh nhân có các yếu tố nguy cơ khác như tăng huyết áp (58%), HDL-C thấp (23%), hút thuốc (16%) hoặc có tiền sử gia đình mắc bệnh mạch vành sớm (12%). Các đối tượng tham gia nghiên cứu có giá trị ban đầu LDL-C trung vị là 108mg/dL và hsCRP là 4,3mg/L. Các bệnh nhân tham gia được dùng ngẫu nhiên giả dược (n=8901) hoặc rosuvastatin 20mg 1 lần/ngày (n=8901) và được theo dõi trong thời gian trung bình 2 năm. Nghiên cứu JUPITER phải ngưng sớm theo những quy tắc xác định trước về ngưng nghiên cứu của ủy ban độc lập theo dõi tính an toàn dữ liệu (Data Safety Monitoring Broad) khi đánh giá hiệu quả trên bệnh nhân dùng rosuvastatin.
Thông số nghiên cứu chính là thông số gộp bao gồm thời gian cho đến khi xảy ra lần đầu bất kì các biến cố tim mạch chính sau: Tử vong do bệnh tim mạch, nhồi máu cơ tim không tử vong, đột quỵ không tử vong, nằm viện do đau thắt ngực không ổn định hoặc thủ thuật tái tưới máu mạch vành.
Rosuvastatin làm giảm đáng kể nguy cơ các biến cố tim mạch chính (252 biến cố ở nhóm giả dược so với 142 biến cố ở nhóm dùng rosuvastatin) với sự giảm nguy cơ tương đối là 44% và giảm nguy cơ tuyệt đối là 1,2% (xem biểu đồ 1). Sự giảm này có ý nghĩa thống kê (p < 0,001). Sự giảm nguy cơ ở thông số nghiên cứu chính đồng nhất với các phân nhóm sau: Tuổi, giới tính, chủng tộc, tình trạng hút thuốc, tiền sử gia đình mắc bệnh mạch vành sớm, chỉ số khối cơ thể, LDL-C, HDL-C và nồng độ hsCRP.
Biểu đồ 1- Thời gian cho đến khi xảy ra lần đầu các biến cố tim mạch chính trong nghiên cứu JUPITER
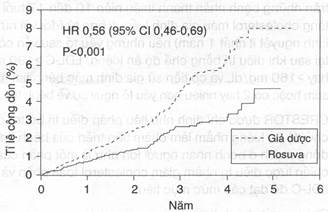
Số lượng bệnh nhân theo dõi
| RSV |
8901 |
8412 |
3892 |
1352 |
543 |
156 |
| Giả dược |
8901 |
8353 |
3872 |
1333 |
534 |
173 |
Những thành phần cụ thể của thông số nghiên cứu chính được giới thiệu trong biểu đồ 2. Rosuvastatin làm giảm đáng kể nguy cơ nhồi máu cơ tim không tử vong, đột quỵ không tử vong và thủ thuật tái tưới máu mạch vành. Không có sự khác biệt đáng kể về mặt điều trị giữa nhóm dùng rosuvastatin hay giả dược về tử vong do nguy cơ tim mạch hay nhập viện vì đau thắt ngực không ổn định.
Rosuvastatin làm giảm đáng kể nguy cơ nhồi máu cơ tim (6 biến cố tử vong và 62 biến cố không tử vong ở nhóm dùng giả dược so với 9 biến cố tử vong và 22 biến cố không tử vong ở nhóm dùng rosuvastatin) và nguy cơ đột quỵ (6 biến cố tử vong và 58 biến cố không tử vong ở nhóm dùng giả dược so với 3 biến cố tử vong và 30 biến cố không tử vong ở nhóm dùng rosuvastatin).
Trong 1 phân tích phân nhóm hậu kiểm (post-hoc) trên những người tham gia nghiên cứu JUPITER (n= 1405, rosuvastatin = 725, giả dược = 680) với hsCRP >= 2mg/l và không có thêm yếu tố nguy cơ nào khác (hút thuốc, huyết áp >= 140/90 hoặc đang điều trị với thuốc trị tăng huyết áp, HDL-C thấp) không tính đến tuổi tác, sau khi điều chỉnh đối với nhóm có HDL-C cao, không thấy có ích lợi điều trị đáng kể khi điều trị bằng rosuvastatin.
Biểu đồ 2: Các biến cố tim mạch chính ở nhóm điều trị trong nghiên cứu JUPITER
| Tiêu chí |
Số lượng các biến cố |
Tỉ số nguy hại (95% CI) |
Giá trị P |
| Rosuva 20mg (n=8901) n (tỉ lệ*) |
Giả dược 20mg (n=8901) n (tỉ lệ*) |
| Tiêu chí nghiên cứu chính |
142 (7,6) |
252(13,6) |
0,56 (0,46; 0,69) |
< 0,001 |
| Chết do bệnh tim mạch** |
35(1,9) |
44 (2,4) |
0,80 (0,51 ;1,24) |
0,315 |
| Đột quỵ không tử vong |
30(1,6) |
58 (3,1) |
0,52 (0,33;0,80) |
0,003 |
| Nhồi máu cơ tim không tử vong |
22(1,2) |
62 (3,3) |
0,35(0,22:0,58) |
< 0,001 |
| Nằm viện do đau thắt ngực không ổn định |
16(0,9) |
27(1,5) |
0,59(0,32:1,10) |
0,093 |
| Tái tưới máu mạch vành |
71 (3,8) |
131 (7,1) |
0,54(0,41:0,72) |
< 0,001 |
* Tỉ lệ biến cố/1000-bệnh nhân năm
** Chết do bệnh tim mạch bao gồm tử vong do nhồi máu cơ tim, tử vong do đột quỵ và các nguyên nhân khác của tử vong do bệnh tim mạch.
Sau 1 năm, rosuvastatin làm tăng HDL-C và làm giảm LDL-C, hs CRP, cholesterol toàn phần và nồng độ triglyceride huyết thanh (p < 0,001) ở tất cả các thông số khi so sánh với giả dược.
Dược động học
Hấp thu:
Nồng độ đỉnh trong huyết tương của rosuvastatin đạt được khoảng 5giờ sau khi uống. Độ sinh khả dụng tuyệt đối khoảng 20%.
Phân bố:
Rosuvastatin phân bố rộng rãi ở gan là nơi chủ yếu tổng hợp cholesterol và thanh thải LDL-C. Thể tích phân bố của rosuvastatin khoảng 134L. Khoảng 90% rosuvastatin kết hợp với protein huyết tương, chủ yếu là với albumin.
Chuyển hóa:
Rosuvastatin ít bị chuyển hoá (khoảng 10%). Các nghiên cứu in vitro về chuyển hoá có sử dụng các tế bào gan của người xác định rằng rosuvastatin là một chất nền yếu cho sự chuyển hoá qua cytochrome P450. CYP2C9 là chất đồng enzym chính tham gia vào quá trình chuyển hoá, 2C19, 3A4 và 2D6 tham gia ở mức độ thấp hơn. Chất chuyển hoá chính được xác định là N-desmethyl và lactone. Chất chuyển hoá N-desmethyl có hoạt tính yếu hơn khoảng 50% so với rosuvastatin trong khi dạng lactone không có hoạt tính về mặt lâm sàng. Rosuvastatin chiếm hơn 90% hoạt tính ức chế HMG-CoA reductase trong tuần hoàn.
Đào thải:
Khoảng 90% liều rosuvastatin được thải trừ ở dạng không đổi qua phân (bao gồm hoạt chất được hấp thu và không được hấp thu) và phần còn lại được bài tiết ra nước tiểu. Khoảng 5% được bài tiết ra nước tiểu dưới dạng không đổi. Thời gian bán thải trong huyết tương khoảng 19giờ. Thời gian bán thải không tăng khi dùng liều cao hơn. Độ thanh thải trong huyết tương trung bình khoảng 50lít/giờ (hệ số biến thiên là 21,7%). Giống như các chất ức chế HMG-CoA reductase khác, sự vận chuyển rosuvastatin qua gan cần đến chất vận chuyển qua màng OATP-C. Chất vận chuyển này quan trọng trong việc đào thải rosuvastatin qua gan.
Tính tuyến tính:
Mức độ tiếp xúc của rosuvastatin tính theo nồng độ và thời gian tăng tỉ lệ với liều dùng. Không có sự thay đổi nào về các thông số dược động học sau nhiều liều dùng hằng ngày.
Các nhóm bệnh nhân đặc biệt
Tuổi tác và giới tính: Tác động của tuổi tác hoặc giới tính trên dược động học của rosuvastatin không liên quan về mặt lâm sàng trên người trưởng thành. Dược động học của rosuvastatin trên trẻ em và thiếu niên bị tăng cholesterol máu gia đình kiểu dị hợp tử thì tương tự trên người tình nguyện trưởng thành.
Chủng tộc: Các nghiên cứu dược động học cho thấy AUC và Cmax tăng khoảng gấp 2 lần ở người Châu Á sống ở Châu Á so với người da trắng sống ở phương Tây. Ảnh hưởng của các yếu tố di truyền và môi trường đối với sự thay đổi này chưa xác định được. Một phân tích dược động học theo quần thể dân cư cho thấy không có sự khác biệt có ý nghĩa lâm sàng về dược động học ở các nhóm người da trắng và người da đen.
Suy thận:
Trong nghiên cứu trên người suy thận ở nhiều mức độ khác nhau cho thấy rằng bệnh thận từ nhẹ đến vừa không ảnh hưởng đến nồng độ rosuvastatin hoặc chất chuyển hoá N-desmethyl trong huyết tương. Bệnh nhân suy thận nặng (độ thanh thải creatinin huyết tương < 30ml/phút) có nồng độ thuốc trong huyết tương tăng cao gấp 3 lần và nồng độ chất chuyển hoá N-desmethyl tăng cao gấp 9 lần so với người tình nguyện khoẻ mạnh. Nồng độ của rosuvastatin trong huyết tương ở trạng thái ổn định ở những bệnh nhân đang thẩm phân máu cao hơn khoảng 50% so với người tình nguyện khỏe mạnh.
Suy gan:
Trong nghiên cứu trên người tổn thương gan ở nhiều mức độ khác nhau, không có bằng chứng về tăng mức tiếp xúc của rosuvastatin tính theo nồng độ và thời gian ở những bệnh nhân có điểm số Child-Pugh ≤ 7. Tuy nhiên, 2 bệnh nhân với điểm số Child-Pugh là 8 và 9 có mức độ tiếp xúc của rosuvastatin tính theo nồng độ và thời gian tăng lên tối thiểu gấp 2 lần so với người có điểm số Child-Pugh thấp hơn. Không có kinh nghiệm ở những bệnh nhân với điểm số Child-Pugh > 9.
Dữ liệu an toàn tiền lâm sàng
Dữ liệu tiền lâm sàng cho thấy không có nguy cơ đặc biệt nào trên người dựa trên các nghiên cứu thường quy về dược lý an toàn, độc tính thuốc khi dùng liều lặp lại, độc tính trên gen và khả năng gây ung thư. Một nghiên cứu trước và sau khi sanh ở chuột cho thấy độc tính trên hệ sinh sản là hiển nhiên từ việc giảm kích thước, khối lượng và sự sống sót của chuột con. Những tác động này được ghi nhận ở các liều độc cho chuột mẹ ở liều cao hơn gấp nhiều lần so với liều điều trị.
 Hộp 10 vỉ x 10 viên
Hộp 10 vỉ x 10 viên Hộp 6 vỉ x 10 viên
Hộp 6 vỉ x 10 viên Hộp 5 vỉ x 10 viên
Hộp 5 vỉ x 10 viên Hộp 1 vỉ x 14 viên
Hộp 1 vỉ x 14 viên Hộp 2 vỉ x 10 viên
Hộp 2 vỉ x 10 viên Hộp 2 vỉ x 10 viên
Hộp 2 vỉ x 10 viên

Chưa có đánh giá nào.