| Công dụng | Điều trị COPD |
| Đối tượng sử dụng | Người lớn từ 18 tuổi trở lên |
| Mang thai & Cho con bú | Tham khảo ý kiến bác sĩ |
| Cách dùng | Dùng đường hít |
| Hoạt chất | Glycopyrronium bromide, Indacaterol |
| Danh mục | Thuốc trị hen & bệnh phổi tắc nghẽn mạn tính |
| Thuốc kê đơn | Có |
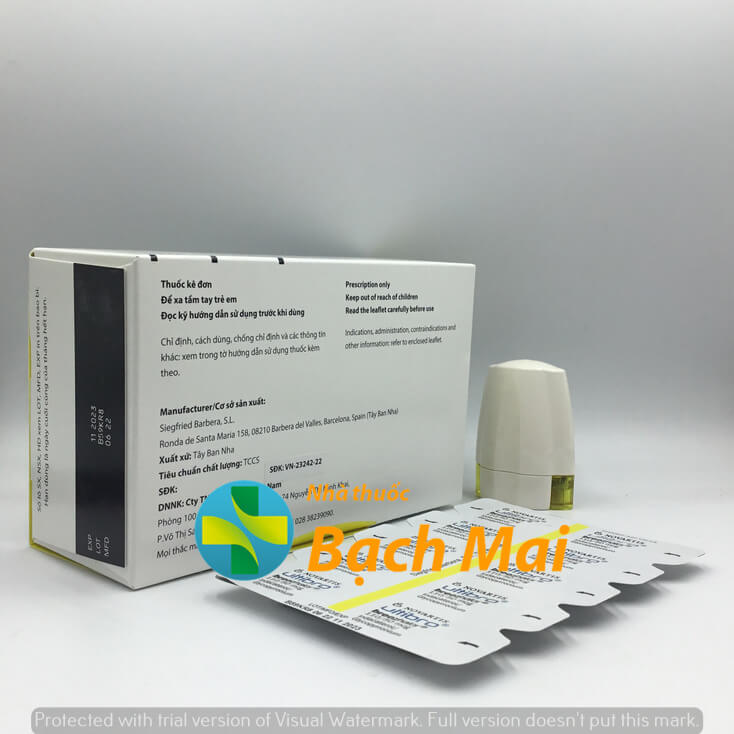
| Xuất xứ | Tây Ban Nha |
| Quy cách | Hộp 3 vỉ x 10 viên |
| Dạng bào chế | Bột hít chứa trong nang cứng |
| Thương hiệu | Novartis |
| Mã SKU | SP01075 |
| Hạn dùng | 18 tháng kể từ ngày sản xuất |
| Số đăng ký | VN-23242-22 |
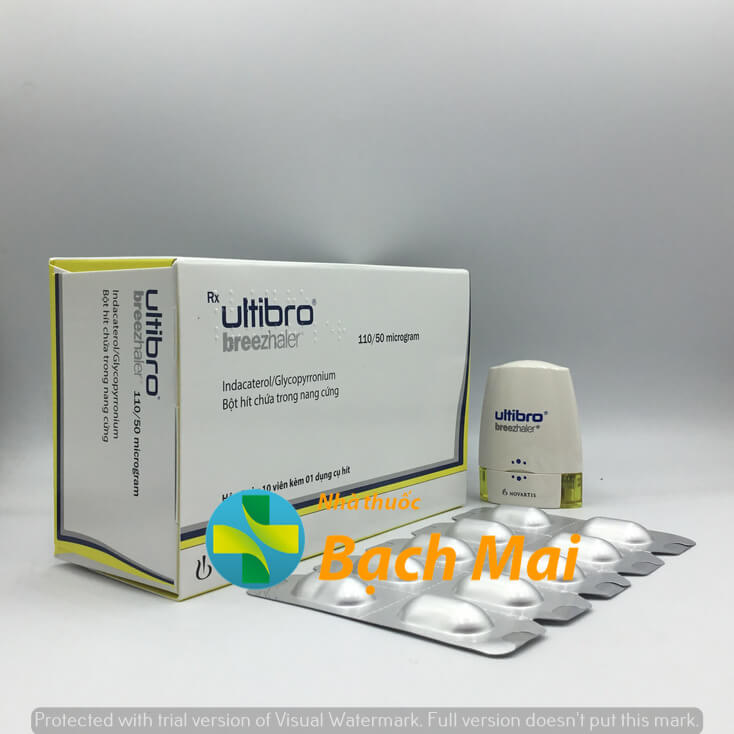
Thuốc Ultibro Breezhaler của Novartis., thành phần chính là sự kết hợp của indacaterol và glycopyrronium. Ultibro Breezhaler là thuốc giãn phế quản được chỉ định dùng một lần/ngày trong điều trị duy trì để làm giảm triệu chứng và làm giảm các đợt cấp ở bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính (COPD).
Nhà thuốc Bạch Mai cam kết
Thuốc Ultibro Breezhaler của Novartis., thành phần chính là sự kết hợp của indacaterol và glycopyrronium. Ultibro Breezhaler là thuốc giãn phế quản được chỉ định dùng một lần/ngày trong điều trị duy trì để làm giảm triệu chứng và làm giảm các đợt cấp ở bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính (COPD).
Thành phần hoạt chất
Mỗi viên nang chứa 143 microgram indacaterol maleat tương đương với 110 microgram indacaterol và 63 microgram glycopyrronium bromid tương đương với 50 microgram glycopyrronium.
Mỗi liều được phóng thích (liều rời khỏi ống ngậm của dụng cụ hít) tương đương với 85 microgram indacaterol và 43 microgram glycopyrronium.
Thành phần tá dược
Thành phần viên nang: Lactose monohydrat, magie stearat.
Thành phần vỏ nang: Hypromellose, nước tinh khiết, carrageenan, kali clorid, FD&C màu vàng 5/Tartrazin.
DẠNG BÀO CHẾ
Bột hít chứa trong nang cứng.
Nắp nang màu vàng trong suốt và phần thân nang trong tự nhiên chứa bột thuốc màu trắng hoặc gần như trắng, với mã sản phẩm “IGP110.50” in màu xanh lơ phía dưới hai vạch màu xanh lơ trên phần thân nang và biểu tượng của hãng in màu đen trên nắp nang.
QUY CÁCH ĐÓNG GÓI: Hộp 3 vỉ x 10 viên nang kèm 1 dụng cụ hít.
Ultibro Breezhaler là thuốc giãn phế quản được chỉ định dùng một lần/ngày trong điều trị duy trì để làm giảm triệu chứng và làm giảm các đợt cấp ở bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính (COPD).
Đối tượng bệnh nhân nói chung
Liều dùng được khuyến cáo của Ultibro Breezhaler là một lần hít trong ngày với lượng thuốc chứa trong một viên nang 110/50 microgram qua dụng cụ hít Ultibro Breezhaler.
Đối tượng đặc biệt
Suy thận
Có thể sử dụng Ultibro Breezhaler ở mức liều khuyến cáo cho bệnh nhân suy thận từ nhẹ đến trung bình. Chỉ nên sử dụng Ultibro Breezhaler cho bệnh nhân suy thận nặng hoặc bệnh thận giai đoạn cuối cần lọc máu nếu hiệu quả của thuốc vượt trội hơn nguy cơ. Xin xem thêm mục CẢNH BÁO VÀ THẬN TRỌNG và ĐẶC TÍNH DƯỢC ĐỘNG HỌC.
Suy gan
Có thể sử dụng Ultibro Breezhaler ở mức liều khuyến cáo cho bệnh nhân suy gan từ nhẹ đến trung bình. Chưa có các dữ liệu trên bệnh nhân suy gan nặng. Xin xem thêm mục ĐẶC TÍNH DƯỢC ĐỘNG HỌC.
Trẻ em (dưới 18 tuổi)
Không sử dụng Ultibro Breezhaler cho bệnh nhân dưới 18 tuổi.
Người cao tuổi (trên 75 tuổi)
Có thể sử dụng Ultibro Breezhaler ở mức liều được khuyến cáo cho bệnh nhân từ 75 tuổi trở lên.
Chỉ dùng viên nang Ultibro Breezhaler theo đường hít qua miệng và chỉ dùng dụng cụ hít Ultibro Breezhaler. Không được nuốt viên nang Ultibro Breezhaler (xem thêm mục QUÁ LIỀU VÀ XỬ TRÍ).
Nên dùng Ultibro Breezhaler vào cùng thời gian mỗi ngày. Nếu quên dùng thuốc, nên dùng lại sớm nhất có thể. Bệnh nhân cần được hướng dẫn để không dùng quá một liều thuốc trong ngày.
Viên nang Ultibro Breezhaler nên được bảo quản trong vỉ nhôm để tránh ẩm, và chỉ bỏ thuốc ra khỏi vỉ NGAY TRƯỚC KHI SỬ DỤNG (xem thêm mục ĐIỀU KIỆN BẢO QUẢN).
Khi kê đơn Ultibro Breezhaler, nên hướng dẫn cho bệnh nhân sử dụng dụng cụ hít đúng cách. Cần hỏi kỹ có phải bệnh nhân đã nuốt thuốc chứ không phải hít thuốc không nếu bệnh nhân không có sự cải thiện nhịp thở. Hướng dẫn sử dụng, xử lý và hủy bỏ
Bộ Ultibro Breezhaler của bạn
Một bộ Ultibro Breezhaler bao gồm:

Chỉ sử dụng dụng cụ hít Ultibro Breezhaler đi kèm trong bộ này. Không sử dụng viên nang Ultibro Breezhaler với bất cứ dụng cụ hít nào khác, không sử dụng dụng cụ hít Ultibro Breezhaler cho bất cứ loại thuốc nang khác nào.
Không ấn viên nang qua lớp giấy bạc để đưa thuốc ra khỏi vỉ.
Bỏ dụng cụ hít sau 30 ngày sử dụng. Hỏi ý kiến dược sỹ về cách vứt bỏ thuốc và dụng cụ hít không còn sử dụng.
Không nuốt viên nang Ultibro Breezhaler. Bột thuốc chứa trong nang chỉ dùng để hít. Sử dụng dụng cụ hít như thế nào.
 |
Kéo nắp ra. |
 |
Mở dụng cụ hít: Giữ chặt để dụng cụ hít và kéo nghiêng ống ngậm để mở dụng cụ. |
 |
Chuẩn bị viên nang: Tách riêng vỉ mang 1 viên nang ra khỏi vỉ thuốc bằng cách xé dọc theo phần được cắt sẵn. Bóc lớp bảo vệ ngay tại vị trí mũi tên để bộc lộ nang. Không ấn viên nang qua lớp giấy bạc. |
 |
Lấy viên nang khỏi vỉ: Phải luôn bảo quản viên nang trong vị thuốc và chỉ lấy viên nang ra ngay trước khi sử dụng. Lấy viên nang ra khỏi vỉ bằng tay khô. Không được nuốt viên nang. |
 |
Đặt viên nang vào dụng cụ hít: Đặt viên nang vào khoang chứa nang. Không được đặt viên nang trực tiếp vào trong ống ngậm. |
 |
Đóng dụng cụ hít: Đóng chặt dụng cụ hít. Bạn cần nghe thấy tiếng “tách’ để đảm bảo dụng cụ đã được đóng chặt hoàn toàn. |
 |
Chọc thủng viên nang: Giữ dụng cụ hít thẳng đứng với phần ống ngậm hướng lên. Ấn chặt đồng thời cả hai nút. Bạn cần nghe thấy một tiếng “tách” khi viên nang được chọc thủng. Chỉ ấn nút chọc thủng một lần. |
 |
Nhả nút hoàn toàn. |
 |
Thở ra: Trước khi đặt ống ngậm vào miệng, hãy thở ra hết sức. Không được thổi vào ống ngậm. |
 |
Hít thuốc: Trước khi hít vào:
Không ấn nút chọc thủng. |
 |
Chú ý: Khi bạn hít vào qua dụng cụ hít, viên nang sẽ xoay trong khoang chứa nang và bạn cần nghe thấy tiếng vo vo. Bạn sẽ cảm nhận được vị ngọt khi thuốc đi vào phổi. Nếu bạn không nghe thấy tiếng vo vo, viên nang có thể đã bị kẹt trong khoang chứa nang. Nếu điều này xảy ra, hãy mở dụng cụ hít và gỡ viên nang ra bằng cách gõ nhẹ vào để dụng cụ. Không ấn nút chọc thủng để gỡ viên nang. Lặp lại bước 9 và 10 nếu cần thiết. |
 |
Nín thở: Tiếp tục nín thở trong ít nhất 5-10 giây hoặc lâu nhất có thể trong khi lấy dụng cụ hít ra khỏi miệng. Sau đó, thở ra. Mở dụng cụ hít để kiểm tra còn bột thuốc đọng lại trong viên nang hay không. Nếu có bột thuốc còn lại trong viên nang, đóng dụng cụ hít và lặp lại bước 9 đến 12. Hầu hết bệnh nhân có thể hít hết bột thuốc trong viên nang sau một hoặc hai lần hít. Đôi khi một số bệnh nhân họ sau khi hít thuốc một thời gian ngắn sau khi dùng thuốc. Nếu điều này xảy ra với bạn, đừng lo lắng, nếu viên nang không còn thuốc đọng lại, bạn đã nhận được đủ liều. |
 |
Bỏ viên nang rỗng: Sau khi dùng xong liều hàng ngày của Ultibro Breezhaler, mở ống ngậm, lấy viên nang rỗng ra bằng cách nghiêng nó khỏi khoang chứa nang và bỏ viên nang đi. Đóng dụng cụ hít và đóng nắp. Không được bảo quản viên nang trong dụng cụ hít Ultibro Breezhaler. |
GHI NHỚ:
Không được nuốt viên nang Ultibro Breezhaler.
Chỉ sử dụng dụng cụ hít Ultibro Breezhaler kèm theo hộp thuốc này.
– Phải luôn bảo quản viên nang Ultibro Breezhaler trong vỉ thuốc và chỉ tách ra khỏi vỉ ngay trước khi sử dụng.
– Không đặt trực tiếp viên nang Ultibro Breezhaler vào ống ngậm của dụng cụ hít Ultibro Breezhaler.
– Không ấn nút chọc thủng nhiều hơn một lần.
– Không thổi vào ống ngậm của dụng cụ hít Ultibro Breezhaler.
– Luôn nhả các nút bấm ra trước khi hít.
– Không rửa dụng cụ hít Ultibro Breezhaler bằng nước. Hãy giữ cho bình khô. Xem mục dưới đây “Cách vệ sinh dụng cụ hít của bạn”.
– Không tháo rời dụng cụ hít Ultibro Breezhaler.
– Luôn sử dụng dụng cụ hít Ultibro Breezhaler mới kèm theo hộp thuốc Ultibro Breezhaler mới.
– Không bảo quản viên nang trong dụng cụ hít Ultibro Breezhaler.
– Luôn giữ dụng cụ hít Ultibro Breezhaler và viên nang Ultibro Breezhaler ở nơi khô ráo.
Thông tin bổ sung
Đôi khi, những mảnh nang rất nhỏ có thể đi qua màng lọc và vào miệng của bạn. Nếu điều này xảy ra, bạn có thể cảm nhận những mảnh nang này trên lưỡi của bạn. Việc nuốt hoặc hít những mảnh nang này không gây hại.
Xác suất nang bị vỡ ra sẽ tăng lên nếu nang bị đâm thủng nhiều hơn một lần (bước 7).
Cách vệ sinh dụng cụ hít của bạn
Không rửa dụng cụ hít bằng nước. Nếu bạn muốn vệ sinh dụng cụ hít của bạn, lau bên trong và bên ngoài ống ngậm bằng vải mềm và khô để loại bỏ phần bột thuốc còn lại. Giữ cho dụng cụ hít khô.
Chống chỉ định dùng Ultibro Breezhaler cho bệnh nhân quá mẫn với indacaterol hoặc glycopyrronium, một thành phần của Ultibro Breezhaler, hoặc bất cứ thành phần tá dược nào của thuốc.
Thuốc này chỉ dùng theo đơn thuốc.
Để xa tầm tay trẻ em.
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Thông báo ngay cho bác sỹ hoặc dược sỹ những phản ứng có hại gặp phải khi sử dụng thuốc.
Không nên dùng đồng thời Ultibro Breezhaler với các thuốc có chứa chất đồng vận beta-adrenergic tác dụng kéo dài hoặc các thuốc đối kháng thụ thể muscarinic tác dụng kéo dài, các thuốc có trong thành phần của Ultibro Breezhaler thuộc về những nhóm thuốc này (xem mục TƯƠNG TÁC, TƯƠNG KỴ CỦA THUỐC).
Hen phế quản
Không nên dùng Ultibro Breezhaler để điều trị hen phế quản do thiếu các dữ liệu cho chỉ định này.
Các chất đồng vận beta,-adrenergic tác dụng kéo dài có thể làm tăng nguy cơ các biến cố bất lợi liên quan đến hen phế quản, bao gồm cả tử vong liên quan đến hen phế quản, khi sử dụng thuốc để điều trị hen phế quản.
Không sử dụng thuốc trong các trường hợp cấp tính
Ultibro Breezhaler không được chỉ định để điều trị các cơn co thắt phế quản cấp.
Quá mẫn cảm
Các phản ứng quá mẫn tức thời đã được báo cáo sau khi dùng indacaterol hoặc glycopyrronium, một thành phần của Ultibro Breezhaler. Nếu xuất hiện các dấu hiệu của phản ứng dị ứng, đặc biệt là phù mạch (bao gồm khó thở hoặc khó nuốt, sưng lưỡi, môi và mặt), nổi mề đay hoặc phát ban da, nên ngừng dùng thuốc ngay lập tức và tiến hành điều trị thay thế.
Co thắt phế quản nghịch lý
Giống như các liệu pháp điều trị dạng hít khác, dùng Ultibro Breezhaler có thể dẫn đến co thắt phế quản nghịch lý có thể gây đe dọa đến tính mạng. Nếu xuất hiện biểu hiện co thắt phế quản nghịch lý, nên ngừng dùng Ultibro Breezhaler ngay lập tức và tiến hành điều trị thay thế.
Tác dụng kháng cholinergic liên quan đến glycopyrronium
Tương tự các thuốc kháng cholinergic khác, nên thận trọng khi sử dụng Ultibro Breezhaler cho bệnh nhân bị glôcôm góc đóng hoặc bí tiểu.
Bệnh nhân nên được tư vấn về các dấu hiệu và triệu chứng của bệnh glôcôm góc đóng cấp tính và nên được tu vấn dừng sử dụng Ultibro Breezhaler và liên lạc ngay với bác sĩ nếu xuất hiện bất kỳ dấu hiệu hoặc triệu chứng tiến triển nói trên.
Bệnh nhân suy thận nặng
Chỉ sử dụng Ultibro Breezhaler cho bệnh nhân suy thận nặng (tốc độ lọc cầu thận ước tính dưới 30 mL/phút/1,73 m2) bao gồm cả các bệnh nhân suy thận giai đoạn cuối cần lọc máu trong trường hợp lợi ích của thuốc vượt trội hơn nguy cơ (xem mục ĐẶC TÍNH DƯỢC ĐỘNG HỌC). Các bệnh nhẫn này nên được theo dõi chặt các phản ứng bất lợi của thuốc.
Tác dụng toàn thân của các chất đồng vận beta
Mặc dù không thường xuyên ghi nhận được các ảnh hưởng có ý nghĩa lâm sàng của thuốc trên tim mạch sau kh dùng Ultibro Breezhaler ở mức liều khuyến cáo, tương tự các thuốc đồng vận beta2-adrenergic khác, nên thận trọng khi sử dụng Ultibro Breezhaler cho bệnh nhân có bệnh lý tim mạch (bệnh mạch vành, nhồi máu cơ tim cấp loạn nhịp tim, tăng huyết áp), bệnh nhân mắc động kinh hoặc nhiễm độc tuyến giáp và các bệnh nhân có đáp ứng bất thường với các thuốc đồng vận beta2-adrenergic.
Tương tự các thuốc khác có chứa chất đồng vận beta,-adrenergic dạng hít, không nên sử dụng Ultibro Breezhaler nhiều lần hơn hoặc cao hơn liều khuyến cáo.
Tác dụng trên tim mạch của các chất đồng vận beta
Tương tự các thuốc có chứa chất đồng vận beta,-adrenergic khác, Ultibro Breezhaler có thể gây ảnh hưởng trên tim mạch có ý nghĩa lâm sàng ở một số bệnh nhẫn thể hiện qua tăng nhịp tim, huyết áp, và/hoặc có triệu chứng.
Trong những trường hợp này, cần cân nhắc ngừng dùng thuốc. Hơn nữa, các chất đồng vận beta-adrenergic đã được ghi nhận gây ra những biến đổi trên làm thay đổi điện tâm đồ như làm sóng T phẳng, kéo dài khoảng QT và làm đoạn ST chênh xuống, mặc dù ý nghĩa lâm sàng của các hiện tượng này chưa được biết rõ.
Tác động có ý nghĩa lâm sàng liên quan đến kéo dài khoảng QTc chưa được ghi nhận trong các thử nghiệm lâm sàng của Ultibro Breezhaler sử dụng liều điều trị được khuyến cáo (xem mục ĐẶC TÍNH DƯỢC LỰC HỌC).
Hạ kali máu của các chất đồng vận beta
Các chất đồng vận beta,-adrenergic có thể làm giảm nồng độ kali máu rõ rệt trên một số bệnh nhân dẫn đến các tác dụng bất lợi trên tim mạch. Sự giảm kali huyết thanh thường hồi phục, không yêu cầu phải bổ sung thêm kali.
Ở bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính nặng, hạ kali máu có trầm trọng hơn do tình trạng thiếu oxy và các thuốc điều trị phối hợp khác (xem mục TƯƠNG TÁC, TƯƠNG KỴ CỦA THUỐC) có thể làm tăng nguy cơ loạn nhịp.
Tác động có ý nghĩa lâm sàng liên quan đến hạ kali máu chưa được quan sát thấy trong các nghiên cứu lâm sàng với Ultibro Breezhaler ở mức liều điều trị được khuyến cáo (xem mục ĐẶC TÍNH DƯỢC ĐỘNG HỌC).
Tăng glucose máu với các chất đồng vận beta
Sử dụng liều cao dạng hít các chất đồng vận beta,-adrenergic có thể làm tăng glucose huyết tương. Bệnh nhân đái tháo đường nên được theo dõi chặt hơn khi bắt đầu điều trị bằng Ultibro Breezhaler. Trong các thử nghiệm lâm sàng dài hạn ([ENLIGHTEN] và [RADIATE]), tỷ lệ bệnh nhân dùng Ultibro Breezhaler có các thay đổi đường huyết có ý nghĩa lâm sàng (4,9%) cao hơn so với placebo (2,7%). Ultibro Breezhaler chưa được nghiên cứu trên bệnh nhân đái tháo đường không được kiểm soát tốt đường huyết.
Dữ liệu về tính an toàn của Ultibro Breezhaler được trình bày dựa trên dữ liệu ghi nhận được với Ultibro Breezhaler và các thành phần đơn trị liệu riêng lẻ của thuốc.
Tóm tắt dữ liệu về tính an toàn
Dữ liệu về độ an toàn với Ultibro Breezhaler bao gồm phơi nhiễm với thuốc tới 15 tháng ở mức liều điều trị (110/50 microgram).
Chương trình phát triển nghiên cứu lâm sàng pha 3 với Ultibro Breezhaler bao gồm 11 nghiên cứu và được thực hiện trên hơn 10000 bệnh nhân được chẩn đoán lâm sàng mắc bệnh phổi tắc nghẽn mạn tính ở mức độ từ trung bình đến rất nặng. Dữ liệu an toàn từ 9 trong số các nghiên cứu này với thời gian điều trị kéo dài 4 tuần hoặc lâu hơn được tập hợp từ 4352 bệnh nhân sử dụng Ultibro Breezhaler 110/50 microgram một lần trong ngày.
Tính an toàn được đặc trưng bởi các triệu chứng kháng cholinergic và beta-adrenergic điển hình liên quan đến các thành phần đơn trị liệu riêng lẻ của thuốc. Các phản ứng bất lợi khác thường gặp nhất liên quan đến thuốc (≥3% và cao hơn so với giả dược) bao gồm đau đầu, họ và viêm mũi họng.
Ở mức liều khuyến cáo, các phản ứng bất lợi của Ultibro Breezhaler trên bệnh nhân bị bệnh phổi tắc nghẽn mạn tính cho thấy tác dụng kích thích beta,-adrenergic toàn thân không đáng kể về mặt lâm sàng. Sự thay đổi về nhịp tim trung bình dưới 1 nhịp/phút và nhịp tim nhanh ít gặp và được ghi nhận với tỷ lệ thấp hơn so với giả dược. Không thấy sự khác biệt về sự kéo dài khoảng QTcF liên quan so với giả dược. Tần suất kéo dài rõ rệt khoảng QTcF [ví dụ >450 ms] và các ghi nhận về hạ kali máu tương tự như giả dược.
Bảng tóm tắt các phản ứng bất lợi của thuốc từ các thử nghiệm lâm sàng
Các phản ứng bất lợi của được liệt kê theo hệ cơ quan theo MedDRA (Bảng 1). Tần suất phản ứng bất lợi của thuốc dựa trên 3 thử nghiệm lâm sàng gộp pha III có đối chứng với giả dược trong khoảng thời gian 6 tháng và 12 tháng. Phân loại tần suất tương ứng cho mỗi phản ứng bất lợi dựa trên quy ước dưới đây (CIOMS III): phổ biển (≥1/10); thường gặp (≥1/100 đến <1/10); ít gặp (≥1/1.000 đến <1/100); hiếm gặp (≥1/10.000, <1/1.000) và rất hiếm gặp (<1/10.000).
Các phản ứng bất lợi của Ultibro Breezhaler tương tự với các phản ứng bất lợi của các thành phần đơn trị liệu.
Do Ultibro Breezhaler có chứa indacaterol và glycopyrronium, loại phản ứng bất lợi và mức độ nghiêm trọng liên quan đến mỗi thành phần đơn trị liệu đều được dự kiến đối với dạng kết hợp.
Bảng 1 Tỷ lệ tích lũy Kaplan-Meier (%) của các phản ứng bất lợi của thuốc ở tuần 52 (Bệnh nhân COPD có đối chứng với giả dược)
| Các phản ứng bất lợi của thuốc |
Indacaterol/ glycopyrronium 110/50 μg một lần/ngày N=1106 Tỉ lệ (95 % CI) |
Giả dược N=748 Tỉ lệ (95 % CI) |
Phân loại tần suất |
| Nhiễm trùng và nhiễm ký sinh trùng | |||
| Nhiễm trùng đường hô hấp trên | 16,96 (14,53; 19,74) | 19,64 (16,67; 23,06) | Phổ biến |
| Viêm họng hầu | 9,03 (7,26; 11,20) | 8,78 (6,77; 11,37) | Thường gặp |
| Nhiễm trùng đường tiết niệu | 2,86 (1,91; 4,29) | 1.49 (0,80; 2,75) | Thường gặp |
| Viêm xoang | 1,8 (1,11; 2,93) | 1,54 (0,82; 2,88) | Thường gặp |
| Viêm mũi | 1,86 (1,16; 2,99) | 2,98 (1,16; 2,99) | Thường gặp |
| Rối loạn hệ miễn dịch | |||
| Quá mẫn | 2,06 (1,31; 3,21) | 1,90 (1,04; 3,47) | Thường gặp |
| Rối loạn chuyển hóa và dinh dưỡng | |||
| Tăng đường huyết và đái tháo đường | 1,65 (0,92; 2,95) | 2,42 (1,46; 4,00) | Thường gặp |
| Rối loạn tâm thần | |||
| Mất ngủ | 0,81 (0,37; 1,76) | 0,98 (0,44; 2,21) | Ít gặp |
| Rối loạn hệ thần kinh | |||
| Chóng mặt | 1,74 (1,05; 2,88) | 0,95 (0,42; 2,14) | Thường gặp |
| Đau đầu | 3,24 (2,28; 4,60) | 2,66 (1,64; 4.29) | Thường gặp |
| Dị cảm | 0,09 (0,01; 0,64) | (0) | Hiếm gặp |
| Rối loạn thị giác | |||
| Glôcôm* | 0,19 (0,05; 0,75) | (0) | Ít gặp |
| Rối loạn trên tim | |||
| Bệnh thiếu máu cơ tim | 0,67 (0,32; 1,41) | 0,78 (0,29; 2,12) | Ít gặp |
| Rung nhĩ | 0,8 (0,33; 1,95) | 0,24 (0,03; 1,68) | Ít gặp |
| Nhịp nhanh | 0,39 (0,15; 1,04) | 0,7 (0,29; 1,66) | Ít gặp |
| Đánh trống ngực | 0,73 (0,34; 1,56) | 1,38 (0,68; 2,80) | Ít gặp |
| Rối loạn hô hấp, lồng ngực và trung thất | |||
| Ho | 6,84 (5,38; 8,68) | 5,94 (4,30; 8,17) | Thường gặp |
| Đau họng hầu bao gồm cả kích ứng cổ họng | 2,95 (2,05; 4,23) | 2,71 (1,70; 4,29) | Thường gặp |
| Chảy máu cam | 0,28 (0,09; 0,85) | 0,24 (0,03; 1,68) | Ít gặp |
| Co thắt phế quản nghịch lý | 0,18 (0,05; 0.73) | 0,51 (0,16; 1,64) | Ít gặp |
| Rối loạn tiêu hóa | |||
| Ăn không tiêu | 2,29 (1,49; 3,51) | 2,25 (1,32; 3,81) | Thường gặp |
| Sâu răng | 1,39 (0,79; 2,44) | 0,97 (0,43; 2,19) | Thường gặp |
| Khô miệng | 0,64 (0,31; 1,34) | 0,45 (0,14; 1,39) | Ít gặp |
| Viêm dạ dày ruột | 0,28 (0,06; 1;18) | 0,97 (0,43; 2,18) | Ít gặp |
| Rối loạn trên da và mô dưới da | |||
| Ngứa/phát ban | 0,56 (0,25, 1,25) | 0,91 (0,37; 2,24) | Ít gặp |
| Rối loạn cơ xương và mô liên kết | |||
| Đau cơ xương | 0,92 (0,47; 1,81) | 1,3 (0,60; 2,78) | Ít gặp |
| Chuột rút | 0,85 (0,41; 1,73) | 0,44 (0,14; 1,37) | Ít gặp |
| Đau dữ dội | 0,74 (0,37; 1,47) | 0,14 (0,02; 0,98) | Ít gặp |
| Đau cơ | 0,57 (0.25; 1,26) | 0,53 (0,17; 1,70) | Ít gặp |
Bảng 2 Các phản ứng bất lợi của thuốc từ các báo cáo tự phát và các trường hợp trong y văn (không rõ tần suất)
Rối loạn hệ miễn dịch
Phù mạch
Rối loạn hệ hô hấp, lồng ngực, trung thất
Chứng khó phát âm
Mô tả một số phản ứng bất lợi của thuốc chọn lọc
Các biến cố bất lợi thường gặp nhất với các thuốc kháng cholinergic là khô miệng (0,64% so với 0,45% so với nhóm dùng giả dược); tuy nhiên biến cố bất lợi này được ghi nhận với tần suất thấp hơn khi dùng Ultibro Breezhaler so với khi dùng đơn độc glycopyrronium. Phần lớn các báo cáo khô miệng được xem như có liên quan đến thuốc và ở mức độ nhẹ, không có trường hợp nào nặng. Họ thường gặp nhưng ở mức độ nhẹ.
Một số biến cố bất lợi nghiêm trọng, bao gồm quá mẫn và nhồi máu cơ tim đã được ghi nhận là phản ứng bất lợi của thuốc khi điều trị đơn độc với indacaterol. Các tần suất về phản ứng quá mẫn và thiếu máu cơ tim đã được báo cáo với Ultibro Breezhaler tương ứng là 2,06% so với 1,9% với nhóm dùng giả dược và 0,467% so với 0,78% với nhóm dùng giả dược.
Tương tác liên quan đến Ultibro Breezhaler
Dùng đồng thời dạng hít đường miệng của indacaterol và glycopyrronium ở trạng thái ổn định của cả hai thuốc không ảnh hưởng đến dược động học (PK) của từng thuốc.
Chưa có nghiên cứu tương tác thuốc – thuốc đặc hiệu được thực hiện với Ultibro Breezhaler. Thông tin về khả năng tương tác của Ultibro Breezhaler dựa trên khả năng gây tương tác của từng thành phần đơn trị liệu của thuốc.
Tương tác liên quan đến indacaterol
Nghiên cứu in vitro cho thấy indacaterol có tiềm năng đáng kể gây tương tác ở mức độ chuyển hóa với các thuốc ở nồng độ đạt được sau khi sử dụng thuốc trên lâm sàng (xem mục ĐẶC TÍNH DƯỢC ĐỘNG HỌC – biến đổi sinh học/chuyển hóa và thải trừ).
Các thuốc chẹn beta-adrenergic
Các thuốc chẹn beta-adrenergic có thể làm giảm hoặc đối kháng với tác dụng của các thuốc đồng vận beta2-adrenergic.
Do đó, không nên dùng Ultibro Breezhaler cùng các thuốc chẹn beta-adrenergic (bao gồm cả các thuốc nhỏ mắt) trừ khi có những lý do thuyết phục về sự kết hợp này. Trong trường hợp cần thiết, nên ưu tiên lựa chọn các thuốc chẹn beta-adrenergic chọn lọc trên tim, mặc dù nên sử dụng thận trọng.
Các thuốc có khả năng kéo dài khoảng QTc
Tương tự các thuốc chứa chất đồng vận beta2-adrenergic, nên thận trọng khi sử dụng Ultibro Breezhaler cho bệnh nhân đang dùng các thuốc ức chế monoamine oxidase, các thuốc chống trầm cảm ba vòng hoặc các thuốc đã được biết đến làm kéo dài khoảng QT, vì có thể làm tăng tác dụng của các thuốc này trên khoảng QT. Các thuốc được biết là làm kéo dài khoảng QT có thể làm tăng nguy cơ gây loạn nhịp thất (xem mục CẢNH BÁO VÀ THẬN TRỌNG).
Các thuốc cường giao cảm
Sử dụng đồng thời với các thuốc cường giao cảm khác (đơn độc hoặc ở trong dạng phối hợp) có thể làm tăng tác dụng bất lợi của indacaterol (xem mục CẢNH BÁO VÀ THẬN TRỌNG).
Các thuốc hạ kali máu
Sử dụng đồng thời với các dẫn chất methylxanthin, các steroid, hoặc các thuốc lợi tiểu không giữ kali có thể làm tăng tác dụng hạ kali máu của các thuốc đồng vận beta2-adrenergic (xem mục CẢNH BÁO VÀ THẬN TRỌNG).
Tương tác liên quan đến chuyển hóa và vận chuyển thuốc
Việc ức chế hai thành phần quan trọng trong quá trình thải trừ của indacaterol là CYP3A4 và P-gp, không ảnh hưởng đến độ an toàn của indacaterol ở liều điều trị. Các nghiên cứu về tương tác thuốc đã được thực hiện với các thuốc ức chế mạnh và đặc hiệu CYP3A4 và P-gp (như ketoconazol, erythromycin, verapamil và ritonavir).
Verapamil được sử dụng làm chất ức chế P-gp làm tăng từ 1,4 đến 2 lần diện tích dưới đường cong (AUC) và tăng 1,5 lần giá trị Cmax của indacaterol. Sử dụng indacaterol cùng với erythromycin làm tăng 1,4 đến 1,6 lần diện tích dưới đường cong và 1,2 lần giá trị Cmax.
Ketokonazol ức chế mạnh đồng thời P-gp và CYP3A4 làm tăng 2 lần diện tích dưới đường cong và 1,4 lần giá trị Cmax.
Điều trị đồng thời với ritonavir, một thuốc ức chế đồng thời cả P-gp và CYP3A4 làm tăng 1,6 đến 1,8 lần diện tích dưới đường cong nhưng không làm ảnh hưởng đến Cmax.
Tóm lại, các dữ liệu cho thấy độ thanh thải toàn phần của thuốc bị ảnh hưởng bởi hoạt động của cả P-gp và CYP3A4 và sự gia tăng 2 lần diện tích dưới đường cong (AUC) gây ra bởi ketokonazol, một chất ức chế mạnh đồng thời P-gp và CYP3A4, phản ánh tác động tối đa của sự ức chế kép hai tác nhân này. Mức độ phơi nhiễm thuốc tăng do tương tác thuốc không có bất kỳ ảnh hưởng nào đến độ an toàn của thuốc thể hiện qua các kinh nghiệm về độ an toàn trong quá trình điều trị bằng indacaterol trong các thử nghiệm lâm sàng sử dụng thuốc trên một năm ở mức liều 600 microgram.
Tương tác liên quan đến glycopyrronium
Các nghiên cứu in vitro cho thấy glycopyrronium dường như không gây ức chế hoặc cảm ứng quá trình chuyên c hóa của các thuốc khác, và các quá trình bao gồm vận chuyển thuốc. Quá trình chuyển hóa với sự tham gia của nhiều enzym, đóng vai trò thứ yếu trong quá trình thải trừ của glycopyrronium (xem mục ĐẶC TÍNH DƯỢC ĐỘNG HỌC− Chuyển hóa sinh học/chuyển hóa và thải trừ). Ức chế hoặc cảm ứng quá trình chuyển hóa của glycopyrronium dường như không làm thay đổi nồng độ thuốc toàn thân.
Các thuốc kháng cholinergic
Sử dụng đồng thời Ultibro Breezhaler với các thuốc kháng cholinergic dạng hít chưa được nghiên cứu, do đó tương tự các thuốc kháng cholinergic khác, việc sử dụng đồng thời Ultibro Breezhaler với các thuốc này không được khuyến cáo.
Cimetidin hoặc các thuốc ức chế hệ vận chuyển cation hữu cơ khác
Trong một nghiên cứu lâm sàng trên người tình nguyện khỏe mạnh, cimetidin, một chất ức chế hệ vận chuyển qua cation hữu cơ được cho là có liên quan đến sự bài tiết qua thận của glycopyrronium, làm tăng 22% nồng đ của glycopyrronium trong tuần hoàn (AUC) và giảm 23% độ thanh thải thận. Dựa trên mức độ của sự thay đổi này, dự kiến không có tương tác thuốc khi dùng glycopyrronium đồng thời với cimetidin hoặc các thuốc ức chế hệ vận chuyển cation hữu cơ khác.
Tính tương kỵ
Không áp dụng.
Phụ nữ có khả năng mang thai
Không có khuyến cáo đặc biệt đối với phụ nữ có khả năng mang thai.
Phụ nữ có thai
Chưa có các dữ liệu trong việc sử dụng Ultibro Breezhaler cho phụ nữ có thai. Tương tự, chưa có các dữ liệu trong việc sử dụng indacaterol hoặc glycopyrronium cho phụ nữ có thai.
Thuốc không gây ảnh hưởng trên phôi thai hoặc bào thai ở bất cứ mức liều nào của Ultibro Breezhaler trong nghiên cứu trên sự phát triển của phôi thai trên chuột cống. Indacaterol không gây quái thai trên chuột cống hoặc thỏ sau khi tiêm dưới da. Độc tính sinh sản đã được thấy đối với indacaterol như làm tăng tần suất một đột biến khung sau khi cho thỏ dùng thuốc (xem mục DỮ LIỆU AN TOÀN PHI LÂM SÀNG). Glycopyrronium không gây quái thai trên chuột cống hoặc thỏ sau khi dùng đường hít (xem mục DỮ LIỆU AN TOÀN PHI LÂM SÀNG).
Trên những phụ nữ sinh mổ, 86 phút sau khi tiêm bắp liều đơn 0,006 mg/kg glycopyrronium bromide, nồng độ thuốc trong huyết tương cuống rốn là rất thấp.
Nguy cơ tiềm ẩn của thuốc trên người chưa được biết. Do chưa có đủ kinh nghiệm sử dụng thuốc trên phụ nữ có thai, chỉ nên sử dụng Ultibro Breezhaler trong thời kỳ mang thai nếu hiệu quả của thuốc vượt trội hơn nguy cơ của thuốc trên thai nhi.
Phụ nữ cho con bú
Chưa rõ có phải indacaterol và/ hoặc glycopyrronium bài tiết vào sữa mẹ hay không. Indacaterol và glycopyrronium (bao gồm cả các chất chuyển hóa của nó) đã được phát hiện trong sữa của chuột cống đang cho con bú. Do đó, chỉ nên sử dụng Ultibro Breezhaler cho phụ nữ cho con bú khi lợi ích của thuốc vượt trội hơn nguy cơ của thuốc trên trẻ sơ sinh (xem mục DỮ LIỆU AN TOÀN PHI LÂM SÀNG).
Khả năng sinh sản
Thông tin liên quan đến indacaterol và glycopyrronium
Các nghiên cứu trên khả năng sinh sản hoặc các dữ liệu khác trên động vật không cho thấy quan ngại nào về khả năng sinh sản ở cả nam và nữ (xem mục DỮ LIỆU AN TOÀN PHI LÂM SÀNG).
Quá trình chuyển dạ và sinh con
Thông tin liên quan đến indacaterol
Tương tự các thuốc đồng vận beta2-adrenergic khác, Ultibro Breezhaler có thể ức chế quá trình chuyển dạ do tác dụng giãn cơ trơn tử cung.
Thông tin liên quan đến Ultibro Breezhaler
Trong một nghiên cứu trên người tình nguyện khỏe mạnh dùng liều đơn gấp 4 lần mức liều điều trị của Ultibro Breezhaler (4 liều, mỗi liều 110/50 microgram cách một giờ dùng một lần) cho thấy thuốc dung nạp tốt, không ảnh hưởng đến nhịp tim, khoảng QTc, nồng độ kali huyết thanh hoặc glucose máu.
Trên bệnh nhân COPD, dùng liều lên tới 600/100 microgram Ultibro Breezhaler dạng hít trong 2 tuần, không ghi nhận được ảnh hưởng trên nhịp tim, khoảng QTc, glucose máu hoặc kali huyết thanh. Có sự gia tăng ngoại tâm thu thất sau 14 ngày dùng liều 300/100 và 600/100 microgram Ultibro Breezhaler nhưng với tỷ lệ thấp và số lượng bệnh nhân nhỏ (N=49 và N=51 tương ứng khi dùng Ultibro Breezhaler liều 600/100 microgram và 300/100 microgram) đã không cho phép phân tích chính xác tỷ lệ này. Trong tổng số 4 bệnh nhân nhịp nhanh thất không liên tục, cơn nhịp nhanh thất dài nhất được ghi lại là 9 nhịp (4 giây).
Quá liều có thể dẫn đến tác dụng kích thích quá mức beta2-adrenergic điển hình như nhịp nhanh, run, đánh trống ngực, đau đầu, buồn nôn, nôn, buồn ngủ, rối loạn nhịp thất, nhiễm acid chuyển hóa, hạ kali máu và tăng glucose huyết hoặc có thể gây ra tác dụng kháng cholinergic, như tăng nhãn áp (gây đau, rối loạn thị giác hoặc đỏ mắt), táo bón hoặc tiểu khó. Điều trị hỗ trợ và điều trị triệu chứng được chỉ định trong trường hợp này. Trong trường hợp nghiêm trọng, nên cho bệnh nhân nhập viện. Sử dụng các thuốc chẹn beta chọn lọc trên tim có thể được cân nhắc để điều trị các triệu chứng cường beta2-adrenergic nhưng phải dưới sự giám sát của bác sĩ và cần hết sức thận trọng vì sử dụng các thuốc chẹn beta-adrenergic có thể gây co thắt phế quản.
Thông tin liên quan đến indacaterol
Trên các bệnh nhân mắc bệnh tắc nghẽn phổi mạn tính, sử dụng liều đơn 3000 microgram có liên quan đến sự gia tăng vừa phải nhịp tim, huyết áp tâm thu và khoảng QTc.
Thông tin liên quan đến glycopyrronium
Trên bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính, dùng lặp lại glycopyrronium dạng hít đường miệng với tổng liều 100 và 200 microgram một lần trong ngày trong 28 ngày trở ra được dung nạp tốt.
Ngộ độc cấp tính do vô ý nuốt viên nang glycopyrronium khó xảy ra do sinh khả dụng đường uống của thuốc thấp (khoảng 5%).
Trên người tình nguyện khỏe mạnh, nồng độ đỉnh huyết tương và tổng lượng thuốc trong tuần hoàn sau khi tiêm tĩnh mạch 150 microgram glycopyrronium bromid (tương đương 120 microgram glycopyrronium) gấp khoảng 50 lần so với nồng độ đỉnh và 6 lần tổng lượng thuốc trong tuần hoàn ở trạng thái ổn định sau khi dùng liều khuyến cáo (50 microgram một lần/ngày) của glycopyrronium và được dung nạp tốt.
HẠN DÙNG: 18 tháng kể từ ngày sản xuất
ĐIỀU KIỆN BẢO QUẢN: Bảo quản ở nhiệt độ không quá 30°C. Tránh ẩm.
CƠ SỞ SẢN XUẤT: Siegfried Barbera, S.L.
Ronda de Santa Maria 158, 08210 Barbera Del Valles, Barcelona, Spain (Tây Ban Nha).
Nhóm dược lý: Adrenergic kết hợp kháng cholinergic
Mã ATC: R03AL04
Cơ chế tác động
Ultibro Breezhaler
Khi indacaterol và glycopyrronium được dùng kết hợp trong Ultibro Breezhaler, hai thuốc này tạo ra tác dụng hiệp đồng cộng do cơ chế tác dụng của thuốc tác động trên các thụ thể khác nhau và khác nhau về cơ chế làm giãn các cơ trơn nhỏ. Do sự khác biệt về mật độ của thụ thể beta2-adrenergic và thụ thể M3 ở trung tâm so với các đường dẫn khí nhỏ hơn, các thuốc đồng vận beta2 có hiệu quả hơn trong việc làm giãn các đường dẫn khi nhỏ, trong khi thuốc kháng cholinergic có thể có hiệu quả hơn trên đường dẫn khí lớn. Do đó, kết hợp một chế đồng vận beta, với một thuốc kháng thụ thể muscarinic có thể đem lại lợi ích để đạt hiệu quả giãn phế quản tối ưu trên tất cả các vùng phổi.
Indacaterol
Indacaterol là một chất đồng vận beta2-adrenergic tác dụng “siêu” kéo dài được dùng một lần trong ngày. Tác dụng dược lý của các chất đồng vận trên thụ thể beta,-adrenergic, bao gồm cả indacaterol, ít nhất một phần do kích thích adenyl cyclase nội bào, enzym xúc tác quá trình chuyển adenosin triphosphat (ATP) thành 3, 5’-adenosine monophosphate vòng (monophosphat vòng). Tăng nồng độ AMP vòng dẫn đến giãn cơ trơn phế quản. Các nghiên cứu in vitro cho thấy indacaterol tác dụng đồng vận trên thụ thể beta, mạnh hơn 24 lần trên thụ thể thụ thể beta, và mạnh hơn 20 lần trên thụ thể beta2. Đặc tính chọn lọc này tương tự formoterol.
Sau khi hít, indacaterol tác dụng tại chỗ trên phổi như một chất giãn phế quản. Indacaterol là một chất đồng vận hầu như hoàn toàn trên thụ thể beta,-adrenergic ở người ở nồng độ nanomol. Trên phế quản người cô lập, indacaterol có tác dụng khởi phát nhanh và kéo dài.
Mặc dù ở người, thụ thể beta2-adrenergic là các thụ thể adrenergic chiếm ưu thế trong cơ trơn phế quản và thụ thể beta2-adrenergic là thụ thể chủ yếu trên tim nhưng vẫn có sự có mặt thụ thể beta,-adrenergic trên tim với tỷ lệ từ 10% đến 50% tổng số các thụ thể adrenergic. Chức năng chính xác của thụ thể beta,-adrenergic trên tim vẫn chưa được biết rõ, nhưng sự có mặt của các thụ thể này dẫn đến khả năng các thuốc đồng vận chọn lọc trên thụ thể beta2-adrenergic vẫn có thể gây ra các tác động trên tim.
Glycopyrronium
Glycopyrronium là một thuốc đối kháng thụ thể muscarinic dạng hít tác dụng kéo dài (kháng cholinergic) dùng một lần trong ngày trong điều trị giãn phế quản duy trì trên bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính. Dây thần kinh phó giao cảm là con đường thần kinh gây co thắt phế quản chủ yếu tại đường hô hấp và trương lực phó giao cảm là thành phần chính có thể đảo ngược gây tắc nghẽn đường dẫn khí trong bệnh phổi tắc nghẽn mạn tính. Glycopyrronium ức chế tác dụng của acetylcholin, là tác nhân gây co thắt phế quản trên các tế bào cơ trơn của đường dẫn khí, do đó làm giãn đường dẫn khí.
Trong 5 phân nhóm thụ thể muscarinic đã biết (M1-5), chỉ có các phân nhóm Ma đã được xác định có chức năng sinh lý trên phổi của người. Glycopyrronium bromid là chất đối kháng có ái lực cao trên ba phân nhóm thụ thể muscarinic này. Các nghiên cứu về khả năng tranh chấp gắn vào thụ thể cho thấy thuốc gắn chọn lọc hơn 4 đến 5 lần trên thụ thể M3 và M1 so với thụ thể M2 trên người. Thuốc có thời gian khởi phát nhanh thể hiện qua các thông số động học của quá trình liên kết/phân ly với thụ thể và tác dụng khởi phát của thuốc sau khi hít trong các nghiên cứu lâm sàng.
Tác dụng kéo dài của thuốc có thể một phần là do nồng độ của thuốc được duy trì trong phổi được phản ánh bởi thời gian bán thải thải trừ kéo dài của glycopyrronium sau khi hít thông qua dụng cụ hít glycopyrronium trái ngược với thời gian bán thải sau khi dùng đường tiêm tĩnh mạch (xem mục ĐẶC TÍNH DƯỢC ĐỘNG HỌC – Thải trừ). Dữ liệu dược động học tại phổi trên chuột cống sau khi hít glycopyrronium bromid bổ sung thêm bằng chứng cho tác dụng này.
Tác dụng dược lực học chính
Kết hợp indacaterol và glycopyrronium trong Ultibro Breezhaler cho thấy tác dụng khởi phát nhanh thời của thuốc trong vòng 5 phút sau khi dùng (xem mục NGHIÊN CỨU LÂM SÀNG, Bảng 3). Tác dụng của thuốc vẫn được duy trì trong vòng 24 giờ giữa các khoảng cách liều (xem mục NGHIÊN CỨU LÂM SÀNG, Hình 1 và 2). Tác dụng giãn phế quản trung bình thu được từ kết quả các lần đo thể tích FEV1 trong 24 giờ là 0,32 L sau 26 tuần điều trị khi so sánh với giả dược. Ultibro Breezhaler có tác dụng vượt trội hơn hẳn khi so sánh với indacaterol, glycopyrronium hoặc tiotropium dùng đơn độc (sự khác biệt 0,11 L trong từng so sánh), (đo phế dung liên tiếp).
Không có các bằng chứng về sự lệ thuộc thuốc của Ultibro Breezhaler theo thời gian khi so sánh với giả dược hoặc các đơn trị liệu của thuốc.
Tác dụng dược lực học thứ cấp
Các tác dụng phụ toàn thân của thuốc đồng vận beta2-adrenergic dạng hít và thuốc đối kháng thụ thể muscarinic dạng hít là kết quả của việc kích hoạt các thụ thể beta2-adrenergic hệ thống và phong bế các thụ thể muscarinic sau khi thuốc được hấp thu vào tuần hoàn chung. Các dữ liệu về tác dụng phụ của Ultibro Breezhaler được nghiên cứu trên người khỏe mạnh và trên những bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính.
Tác dụng trên nhịp tim
Tác dụng của thuốc trên nhịp tim được nghiên cứu trên người tình nguyện khỏe mạnh sau khi dùng liều đơn Ultibro Breezhaler 440/200 microgram chia thành 4 lần dùng, mỗi lần cách nhau 1 giờ và so sánh với tác dụng của giả dược, 600 microgram indacaterol, 200 microgram glycopyrronium và 200 microgram salmeterol. Thời gian nhịp tim tăng nhiều nhất của Ultibro Breezhaler so với giả dược là +5,69 nhịp/phút, giảm mạnh nhất là -2,51 nhịp/phút. Nhìn chung ảnh hưởng đến nhịp tim theo thời gian không phản ánh đặc tính dược lực học ổn định của Ultibro Breezhaler.
Trong khi không có khác biệt đáng kể khi so sánh Ultibro Breezhaler với indacaterol và glycopyrronium đơn độc dường như có sự tăng nhẹ nhịp tim (sự khác biệt lớn nhất vào khoảng 11 nhịp/phút) sau khi hít 200 microgram salmeterol.
Nhịp tim ở bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính dùng mức liều trên mức liều điều trị được nghiên cứu với Ultibro Breezhaler tới mức liều 150/100, 300/100 và 600/100 microgram. Không ghi nhận được ảnh hưởng rõ rệt liên quan đến tác dụng của Ultibro Breezhaler trên nhịp tim trung bình trong vòng 24 giờ hay nhịp tim đánh giá sau 30 phút, 4 giờ và 24 giờ dùng thuốc.
Khoảng QT
Các thành phần của Ultibro Breezhaler (indacaterol và glycopyrronium) chưa được biết liệu có khả năng kéo dài khoảng QT khi dùng ở liều điều trị hay không. Một đánh giá toàn diện QT (TQT) trên người tình nguyện khỏe mạnh với liều đường hít indacaterol lên đến 600 microgram không cho thấy ảnh hưởng có ý nghĩa lâm sàng trên khoảng QT. Tương tự glycopyrronium, không ghi nhận được hiện tượng kéo dài khoảng QT trong nghiên cứu TQT sau khi hít liều 400 microgram.
Ảnh hưởng của Ultibro Breezhaler trên khoảng QTc được nghiên cứu trên người tình nguyện khỏe mạnh sau khi hít Ultibro Breezhaler 440/200 microgram chia làm 4 liều dùng cách nhau 1 giờ. Thời gian khác biệt lớn nhất đạt được khi so sánh với giả dược là 4,62 ms (khoảng tin cậy 90% 0,4 ; 8.85 ms), thời gian giảm lớn nhất là -2,71 ms (khoảng tin cậy 90% -6,97 ; 1,54 ms), cho thấy Ultibro Breezhaler không có ảnh hưởng trên khoảng QT như dự kiến dựa trên đặc tính của các thuốc thành phần.
Trên bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính sử dụng liều lên đến 600/100 microgram Ultibro Breezhaler chưa ghi nhận được ảnh hưởng rõ rệt trên khoảng QTc trên điện tâm đồ ghi nhận liên tiếp từ 15 phút đến 24 giờ sau khi dùng thuốc. Một tỷ lệ nhỏ bệnh nhân có khoảng QTc kéo dài trên 450 ms ở nhóm dùng Ultibro Breezhaler 600/100 microgram. Số lượng bệnh nhân có sự thay đổi QTcF đáng chú ý so với lúc đầu (>30 ms) tương tự giữa tất cả các nhóm điều trị bằng thuốc (Ultibro Breezhaler 600/100 microgram, 300/100 microgram, 150/100 microgram và indacaterol 300 microgram), nhưng thấp hơn so với nhóm dùng giả dược.
Kali huyết thanh và glucose máu
Trên người tình nguyện khỏe mạnh, sau khi dùng Ultibro Breezhaler 440/200 microgram, ảnh hưởng của thuốc trên kali huyết thanh rất nhỏ (sự khác biệt tối đa -0,14 mmol/L khi so sánh với giả dược). Ảnh hưởng tối đa trên glucose máu là 0,67 mmol/L. Khi so sánh Ultibro Breezhaler 440/200 microgram với 200 microgram salmeterol, ảnh hưởng trên kali huyết thanh (sự khác biệt tối đa là 0,21 mmol/L) và glucose máu thấp hơn (sự khác biệt tối đa tương ứng là 0,21 và 1,19 mmol/L).
Hấp thu
Sau khi hít Ultibro Breezhaler, thời gian trung bình để đạt nồng độ đỉnh trong huyết tương của indacaterol và glycopyrronium tương ứng vào khoảng 15 phút và 5 phút.
Dựa trên các dữ liệu in vitro, liều indacaterol phân bố vào phổi được dự kiến tương tự Ultibro Breezhaler 110/50 microgram và indacaterol 150 microgram dùng đơn độc. Nồng độ ở trạng thái ổn định của indacaterol sau khi hít Ultibro Breezhaler liều 110/50 microgram tương tự hoặc thấp hơn một chút so với nồng độ toàn thân sau khi hít indacaterol 150 microgram đơn độc.
Sinh khả dụng tuyệt đối của indacaterol sau khi hít Ultibro Breezhaler 110/50 microgram dao động trong khoảng từ 47% đến 66% trong khi với glycopyrronium là khoảng 40%.
Nồng độ của glycopyrronium ở trạng thái ổn định sau khi hít Ultibro Breezhaler 110/50 microgram tương tự nồng độ toàn thân sau khi hít glycopyrronium 50 microgram đơn độc.
Indacaterol
Thời gian trung bình để đạt được nồng độ đỉnh trong huyết tương của indacaterol là khoảng 15 phút sau khi hít liều đơn hoặc liều lặp lại.
Nồng độ indacaterol trong huyết thanh tăng sau khi dùng lặp lại liều dùng một lần trong ngày. Trạng thái ổn định đạt được trong vòng 12 đến 15 ngày. Tỷ lệ tích lũy trung bình của indacaterol, ví dụ AUC trên khoảng liều 24 giờ vào ngày thứ 14 hoặc 15 so với ngày thứ nhất nằm trong khoảng 2,9 đến 3,8 khi dùng thuốc dạng hít một lần trong ngày ở mức liều từ 75 microgram đến 600 microgram.
Glycopyrronium
Sau khi hít qua đường miệng sử dụng dụng cụ hít glycopyrronium, glycopyrronium nhanh chóng được hấp thu và đạt nồng độ đỉnh trong huyết tương sau 5 phút dùng thuốc.
Khoảng 90% nồng độ toàn thân đạt được sau khi hít là do hấp thu tại phổi và 10% do hấp thu ở đường tiêu hóa.
Sinh khả dụng tuyệt đối đường uống của glycopyrronium ước tính khoảng 5%.
Sau khi hít lặp lại ngày một lần trên bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính, dược động học ở trạng thái ổn định của glycopyrronium đạt được trong vòng 1 tuần điều trị. Nồng độ đỉnh trung bình ở trạng thái ổn định và nồng độ đáy của glycopyrronium khi dùng mức liều 50 microgram một lần trong ngày tương ứng là 166 pg/mL và 8 pg/mL. Với mức liều 100 và 200 microgram 1 lần/ngày, nồng độ ở trạng thái ổn định của glycopyrronium (AUC trong thời gian dùng thuốc) cao hơn khoảng 1,4 đến 1,7 lần so với sau khi dùng liều đầu tiên. Dữ liệu về bài tiết qua nước tiểu ở nồng độ ổn định so với liều đầu tiên cho thấy sự tích lũy toàn thân không phụ thuộc vào liều ở mức liều từ 25 đến 200 microgram.
Phân bố
Indacaterol
Sau khi truyền tĩnh mạch, thể tích phân bố (Vz) của indacaterol từ 2,36 L đến 2,557 L cho thấy thuốc được phân bố rộng rãi. Trong thử nghiệm in vitro, mức độ liên kết với protein huyết thanh và huyết tương người tương ứng là 94,1 đến 95,3% và 95,1 đến 96,2%.
Glycopyrronium
Sau khi dùng đường tiêm tĩnh mạch, thể tích phân bố ở trạng thái ổn định (Vss) của glycopyrronium là 83 L và thể tích phân bố của pha cuối (Vz) là 376 L. Thể tích phân bố biểu kiến ở pha cuối sau khi hít (Vz/F) là 7310 L, phản ánh tốc độ thải trừ chậm hơn nhiều sau khi hít. Trên mô hình in vitro, glycopyrronium liên kết với protein huyết tương người từ 38% đến 41% trong khoảng nồng độ từ 1 đến 10 ng/mL. Nồng độ này cao hơn ít nhất 6 lần nồng độ đỉnh trung bình ở trạng thái ổn định đạt được trong huyết tương khi dùng mức liều 50 microgram 1 lần/ngày.
Chuyển hóa sinh học/ Chuyển hóa
Indacaterol
Trong một nghiên cứu ADME (hấp thu, phân bố, chuyển hóa, thải trừ) trên người sau khi dùng indacaterol gắn phóng xạ đường uống, indacaterol không biến đổi là thành phần chính trong huyết thanh, chiếm khoảng một phần ba tổng lượng thuốc AUC trong 24 giờ. Dẫn chất hydroxyl hóa là chất chuyển hóa chính trong huyết thanh Dạng liên hợp phenolic O-glucuronic của indacaterol và hydroxy indacaterol là các chất chuyển hóa chủ yếu tiếp theo. Một đồng phân diastereomer của dẫn chất hydroxyl, liên hợp N-glucuronic của indacaterol, và dẫn chất C- và N-dealkyl hóa là các chất chuyển hóa đã được xác định tiếp theo.
Các nghiên cứu in vitro cho thấy UGT1A1 là dạng UGT duy nhất chuyển hóa indacaterol thành phenolic O-glucuronic. Các chất chuyển hóa oxy hóa đã được tìm thấy khi ủ thuốc với CYP1A1, CYP2D6 và CYP3A4 tái tổ hợp. CYP3A4 được xác định là isoenzym chính chịu trách nhiệm hydroxyl hóa indacaterol. Các nghiên cứu in vitro tiếp theo cho thấy indacaterol là cơ chất có ái lực thấp với bơm P-gp.
Glycopyrronium
Các nghiên cứu chuyển hóa in vitro cho thấy có sự phù hợp về con đường chuyển hóa của glycopyrronium bromid giữa động vật và người. Không có chất chuyển hóa đặc hiệu nào trên người được tìm thấy. Quá trình hydroxyl hóa tạo ra các dẫn chất chuyển hóa mono- và bis- hydroxyl và quá trình thủy phân trực tiếp tạo ra các dẫn chất carboxylic (M9) đã được quan sát thấy.
Các nghiên cứu in vitro cho thấy nhiều isoenzym CYP tham gia vào quá trình oxy hóa trong chuyển hóa sinh học của glycopyrronium. Quá trình thủy phân tạo M9 có thể được xúc tác bởi các enzym trong nhóm cholinesterase.
Sau khi hít, nồng độ toàn thân của M9 là trên trung bình, cùng nồng độ với thuốc mẹ. Do các nghiên cứu in vitro cho thấy không có quá trình trao đổi chất tại phổi và M9 có mặt ít trong tuần hoàn (khoảng 4% Cmax và AUC của thuốc mẹ) sau khi dùng đường tiêm tĩnh mạch, người ta cho rằng M9 được hình thành từ phần thuốc nuốt phải khi hít glycopyrronium qua đường miệng thông qua quá trình thủy phân trước khi vào tuần hoàn và/ hoặc qua chuyển hóa lần đầu. Sau khi hít cũng như sau khi tiêm tĩnh mạch, chỉ một lượng nhỏ M9 được tìm thấy trong nước tiểu (≤ 0.5% liều). Dạng liên hợp glucuronic và dạng liên hợp sulphat của glycopyrronium được tìm thấy khoảng 3% trong nước tiểu người khi dùng dạng hít liều lặp lại.
Các nghiên cứu ức chế trên in vitro cho thấy glycopyrronium bromid không có khả năng ức chế CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 hoặc CYP3A4/5, bơm tổng thuốc MDR1, MRP2 hoặc MXR, và các chất vận chuyển thuốc vào OATP1B1, OATP1B3, OAT1, OAT3, OCT1 hoặc OCT2. Các nghiên cứu cảm ứng enzym in vitro không chỉ ra được khả năng cảm ứng có ý nghĩa lâm sàng của glycopyrronium bromid với bất cứ isoenzym cytochrom P450 nào, hay với UGT1A1 và các chất vận chuyển thuốc MDR1 và MRP2.
Thải trừ
Indacaterol
Trong các nghiên cứu lâm sàng có thu thập nước tiểu, lượng indacaterol bài tiết dưới dạng không biến đổi nước tiểu nhìn chung thấp hơn 2% liều dùng. Thanh thải thận của indacaterol trung bình dao động từ 0,46 đến 1,20 L/giờ. Khi so sánh với thanh thải huyết thanh của indacaterol từ 18,8 đến 23,3 L/giờ cho thấy thải trừ qua thận đóng vai trò thứ yếu (khoảng 2 -6% thanh thải hệ thống) trong quá trình thải trừ indacaterol toàn thân.
Trong nghiên cứu ADME trên người, trong đó indacaterol được dùng đường uống, thải trừ thuốc qua phân chiếm ưu thế hơn so với con đường thải trừ qua nước tiểu. Trên người, indacaterol được bài tiết qua phân chủ yếu dưới dạng thuốc mẹ không biến đổi (54% liều) và một phần nhỏ hơn dưới dạng chất chuyển hóa hydroxy indacaterol (23% liều). Sự cân bằng về mặt khối lượng là hoàn toàn với >90% liều được tìm thấy trong phân.
Nồng độ indacaterol trong huyết thanh giảm theo nhiều pha với trung bình kết thúc của thời gian bán thải thay đổi từ 45,5 đến 126 giờ. Thời gian bán thải được tính toán từ sự tích lũy của indacaterol sau khi dùng liều lặp lại thay đổi trong khoảng từ 40 đến 56 giờ phù hợp với thời gian đạt được trạng thái ổn định vào khoảng 12 đến 15 ngày.
Glycopyrronium
Sau khi tiêm tĩnh mạch glycopyrronium bromid có gắn [H] cho người, chất phóng xạ bài tiết trung bình qua nước tiểu trong 48 giờ lên đến 85% liều. 5% liều tiếp theo được tìm thấy trong mặt. Do đó, cân bằng về mặt khối lượng gần như hoàn toàn.
Thuốc mẹ được thải trừ qua thận khoảng 60 đến 70% thanh thải toàn phần trong khi thanh thải ngoài thận chiếm khoảng 30 đến 40%. Thanh thải đường mật thuộc về thanh thải ngoài thận, nhưng phần lớn thanh thải ngoài thận được cho là do chuyển hóa.
Sau khi người tình nguyện khỏe mạnh và bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính hít liều đơn và liều lặp lại một lần trong ngày từ 50 đến 200 microgram glycopyrronium, thanh thải thận trung bình của glycopyrronium dao động trong khoảng từ 17,4 đến 24,4 L/giờ. Bài tiết chủ động ở ống thận tham gia vào việc thải trừ glycopyrronium qua thận. Lên đến 20% liều dùng được tìm thấy trong nước tiểu dưới dạng nguyên vẹn của thuốc mẹ.
Nồng độ glycopyrronium huyết tương giảm theo nhiều pha. Thời gian bán thải cuối cùng trung bình dài hơn sau khi hít (33 đến 57 giờ) so với sau khi tiêm tĩnh mạch (6,2 giờ) và sau khi uống (2,8 giờ). Động học thải trừ cho thấy sự hấp thu được duy trì ở phổi và/hoặc vận chuyển glycopyrronium vào tuần hoàn chung 24 giờ và sau 24 giờ sau khi hít.
Tuyến tính / Không tuyến tính
Indacaterol
Nồng độ toàn thân của indacaterol tăng lên khi liều dùng tăng (từ 150 microgram đến 600 microgram) theo kiểu tuyến tính phụ thuộc vào liều. Nồng độ toàn thân là kết quả của cả hấp thu tại phổi và hấp thu tại ruột non.
Glycopyronnium
Nồng độ toàn thân trên bệnh nhân bị mắc bệnh phổi tắc nghẽn mạn tính cũng như tổng lượng bài tiết qua nước tiểu của glycopyrronium ở trạng thái ổn định tăng tuyến tính với liều dùng trong khoảng liều từ 50 microgram đến 200 microgram.
Đối tượng đặc biệt
Ultibro Breezhaler
Phân tích dược động học quần thể trên bệnh nhân bị bệnh phổi tắc nghẽn mãn tính sau khi hít Ultibro Breezhaler cho thấy không có ảnh hưởng đáng kể về tuổi, giới tính và cân nặng (lý tưởng) đến nồng độ toàn thân của indacaterol và glycopyrronium. Cân nặng lý tưởng (tính theo cân nặng và chiều cao) được xác định là một biến đi lập. Mối tương quan nghịch giữa nồng độ toàn thân và cân nặng lý tưởng (hoặc cân nặng) đã được quan sát thể tuy nhiên, không cần phải hiệu chỉnh liều do mức độ thay đổi hoặc độ chính xác dự đoán của cân nặng lý tưởng.
Tình trạng hút thuốc và giá trị FEV, ban đầu không có ảnh hưởng rõ rệt tới nồng độ toàn thân của indacaterol và glycopyrronium sau khi hít Ultibro Breezhaler
Indacaterol
Phân tích quần thể về ảnh hưởng của tuổi, giới tính và cân nặng đến nồng độ toàn thân trên bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính sau khi hít cho thấy indacaterol có thể sử dụng ở mức liều được khuyến cáo trên tất cả các nhóm tuổi và cân nặng và không ảnh hưởng bởi giới tính.
Dược động học của indacaterol được nghiên cứu trên hai kiểu gen khác nhau của UGT1A1 là kiểu gen biểu hiện đầy đủ chức năng [(TA)6, (TA)6,] và kiểu gen biểu hiện kém [(TA)7, (TA)7] (kiểu gen của hội chứng Gilbert). Kết quả nghiên cứu đã cho thấy diện tích dưới đường cong ổn định (AUC) và nồng độ đỉnh (Cmax) của indacaterol cao hơn 1,2 lần ở nhóm người có kiểu gen [(TA)7, (TA)7], cho thấy nồng độ toàn thân của indacaterol chỉ bị ảnh hưởng không có ý nghĩa bởi sự thay đổi kiểu gen UGT1A1.
Glycopyrronium
Một phân tích dữ liệu dược động học quần thể trên bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính đã xác định được cân nặng và tuổi là yếu tố liên quan đến sự biến thiên giữa các cá thể bệnh nhân về nồng độ toàn thân. Có thể sử dụng mức liều glycopyrronium 50 microgram dùng 1 lần/ngày như liều khuyến cáo trên tất cả các nhóm bệnh nhân có độ tuổi và cân nặng khác nhau.
Giới tính, tình trạng hút thuốc và giá trị FEV1 ban đầu không có ảnh hưởng rõ rệt đến nồng độ toàn thân.
Suy gan
Trên cơ sở các đặc tính dược động học lâm sàng khi sử dụng riêng lẻ từng thành phần của thuốc, Ultibro Breezhaler có thể được sử dụng ở mức liều được khuyến cáo trên bệnh nhân suy giảm chức năng gan nhẹ và trung bình. Chưa có các dữ liệu trên đối tượng bệnh nhân suy gan nặng.
Không thấy có sự thay đổi về Cmax hoặc AUC của indacaterol trên bệnh nhân suy giảm chức năng gan nhẹ và trung bình, cũng như không có sự khác biệt về tỷ lệ kết hợp với protein của thuốc ở bệnh nhân suy giảm chức năng gan nhẹ và trung bình so với trên người tình nguyện khỏe mạnh. Các nghiên cứu trên bệnh nhân suy gan nặng chưa được thực hiện.
Các nghiên cứu lâm sàng trên bệnh nhân suy giảm chức năng gan chưa được thực hiện. Glycopyrronium được thải trừ chủ yếu khỏi tuần hoàn chung thông qua con đường bài tiết qua thận (xem mục ĐẶC TÍNH DƯỢC ĐỘNG HỌC – Thải trừ). Suy giảm chức năng chuyển hóa glycopyrronium tại gan không được cho là nguyên nhân làm tăng có ý nghĩa lâm sàng nồng độ thuốc toàn thân.
Suy thận
Dựa trên các đặc tính dược động học lâm sàng khi sử dụng riêng lẻ từng thành phần của thuốc Ultibro Breezhaler có thể được sử dụng ở mức liều được khuyến cáo trên bệnh nhân suy thận nhẹ đến
trung bình. Trên bệnh nhân suy thận nặng hoặc suy thận giai đoạn cuối cần lọc máu, chỉ nên sử dụng Ultibro Breezhaler nếu lợi ích của thuốc vượt trội hơn nguy cơ.
Indacaterol: Do thải trừ thuốc qua nước tiểu ít tham gia vào quá trình thải trừ hoàn toàn indacaterol ra khỏi cơ thể, nghiên cứu trên bệnh nhân suy thận không được thực hiện.
Glycopyrronium: Suy thận có tác động đến nồng độ toàn thân của glycopyrronium. Sự gia tăng trung bình tổng lượng thuốc trong tuần hoàn (AUC cuối) tăng lên đến 1,4 lần trên bệnh nhân suy thận nhẹ và trung bình và tăng lên đến 2,2 lần trên bệnh nhân suy thận nặng và bệnh nhân suy thận giai đoạn cuối. Dựa trên phân tích dược động học quần thể, có thể kết luận rằng trên bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính có suy giảm chức năng thận nhẹ đến trung bình (tốc độ lọc cầu thận ước tính eGFR≥30 mL/phút/1,73 m2) có thể sử dụng glycopyrronium ở mức liều được khuyến cáo.
Chủng tộc/sắc tộc
Ultibro Breezhaler: Khi hiệu chỉnh theo cân nặng lý tưởng, ảnh hưởng của chủng tộc (người Nhật so với không phải là người Nhật) nồng độ của cả hai thành phần của thuốc đều không có ý nghĩa thống kê.
Indacaterol: Không có sự khác biệt được xác định giữa các nhóm chủng tộc. Kinh nghiệm điều trị trên người da đen còn hạn chế.
Glycopyrronium: Không có sự khác biệt lớn về tổng lượng thuốc trong tuần hoàn (AUC) giữa bệnh nhân người Nhật và người da trắng. Chưa có đủ các dữ liệu dược động học trên các dân tộc hoặc chủng tộc khác.
Chương trình nghiên cứu lâm sàng Ultibro Breezhaler pha III [IGNITE] bao gồm 6 nghiên cứu trong đó hơn 8.000 bệnh nhân đã được đưa vào: một nghiên cứu thực hiện trong 26 tuần có đối chứng giả dược và dùng thuốc (indacaterol 150 microgram một lần/ngày, glycopyrronium 50 microgram một lần/ngày, nhãn mở tiotropium 18 microgram một lần/ngày), [SHINE]; một nghiên cứu trong 26 tuần có thuốc đối chứng (fluticasone/ salmeterol 500/50 microgram hai lần/ngày) [ILLUMINATE]; một nghiên cứu 64 tuần có thuốc đối chứng (glycopyrronium 50 microgram một lần/ngày, nhãn mở tiotropium 18 microgram một lần/ngày) [SPARK]; một nghiên cứu 52 tuần có đối chứng giả dược [ENLIGHTEN]; một nghiên cứu trong 3 tuần có đối chứng giả dược và thuốc đối chứng (tiotropium một lần/ngày) nghiên cứu khả năng dung nạp [BRIGHT] với sự tham gia của hơn 5000 bệnh nhân và một nghiên cứu kéo dài 52 tuần (fluticasone / salmeterol 500/50 microgram hai lần một ngày) [FLAME]
Các nghiên cứu này tuyển chọn các bệnh nhân đã được chẩn đoán lâm sàng mắc bệnh phổi tắc nghẽn mạn tính ở mức độ trung bình đến rất nặng, từ 40 tuổi trở lên và có tiền sử hút thuốc ít nhất 10 bao trong năm. Trong số 5 nghiên cứu này, [SHINE] và [ENLIGHTEN] có thể tích FEV1 <80% sau giãn phế quản và 230% giá trị bình thường được dự đoán đồng thời tỷ lệ FEV /FVC sau giãn phế quản dưới 70%. Nghiên cứu 26 tuần có thuốc đối chứng, [ILLUMINATE], tuyển chọn các bệnh nhân có thể tích FEV1 sau giãn phế quản <80% và 240% giá trị bình thường được dự đoán. Trong khi đó, nghiên cứu trong 64 tuần, [SPARK] tuyển chọn các bệnh nhân mắc bệnh phổi tắc nghẽn mạn tính nặng đến rất nặng, với thể tích FEV1 sau giãn phế quản <50% so với giá trị bình thường được dự đoán. Nghiên cứu có đối chứng trong 52 tuần, [FLAME] tuyển chọn các bệnh nhẫn mắc bệnh phổi tắc nghẽn mạn tính từ trung bình đến rất nặng có tiền sử có 21 đợt bùng phát bệnh phổi tắc nghẽn mạn tính trung bình hoặc nặng trong năm vừa qua, với thể tích FEV1 sau giãn phế quản ≥25% và <60% so với giá trị bình thường được dự đoán.
Ảnh hưởng trên chức năng phổi
Ultibro Breezhaler dùng ở mức liều 110/50 microgram một lần trong ngày cho thấy hiệu quả cải thiện chức năm phổi có ý nghĩa lâm sàng (được đo bằng thể tích thở ra gắng sức trong 1 giây, FEV1) trong một số nghiên cứu lâm sàng. Trong các nghiên cứu pha III, tác dụng giãn phế quản xuất hiện trong vòng 5 phút sau khi dùng liều đầu tiên và được duy trì trong 24 giờ giữa các khoảng cách liều kể từ liều đầu tiên. Trong các nghiên cứu thực hiện trong 26 tuần [SHINE] và 52 tuần [ENLIGHTEN], không có sự giảm tác dụng của các thuốc giãn phế quản
trong các thời gian theo thời gian.
Thể tích FEV1 đáy
Trong [SHINE], Ultibro Breezhaler làm tăng thể tích FEV1 đáy sau khi dùng thuốc là 200 mL khi so sánh với nhóm dùng giả dược trên chỉ tiêu đánh giá chính tại tuần thứ 26 (p<0,001) và chỉ số này tăng có ý nghĩa khi so sánh với nhóm điều trị đơn thành phần (indacaterol và glycopyrronium) cũng như nhóm điều trị bằng tiotropium (xem Bảng 2).
Bảng 2 Thể tích FEV, sau khi dùng thuốc (trung bình bình phương tối thiểu) ở ngày 1 and tuần 26 (chi tiêu đánh giá chính)
| Sự khác biệt điều trị | Ngày 1 | Tuần 26 |
| Ultibro Breezhaler – giả dược | 190 mL (p<0,001) | 200 mL (p<0,001) |
| Ultibro Breezhaler – indacaterol | 80 mL (p<0,001) | 70 mL (p<0,001) |
| Ultibro Breezhaler – glycopyrronium | 80 mL (p<0,001) | 90 mL (p<0,001) |
| Ultibro Breezhaler – tiotropium | 80 mL (p<0,001) | 80 mL (p<0,001) |
Thể tích FEV1 trung bình trước khi dùng thuốc (giá trị trung bình được đo trước 45 và 15 phút trước liều buổi sáng của thuốc nghiên cứu) của nhóm dùng Ultibro Breezhaler vượt trội hơn có ý nghĩa lâm sàng và ý nghĩa thống kê ở tuần 26 so với nhóm dùng fluticasone/salmeterol (100 mL, p<0,001) [ILLUMINATE], ở tuần 52 khi so sánh với giả dược (189 mL, p<0,001) [ENLIGHTEN] và ở tất cả các lần thăm khám đến tuần 64 khi so sánh với glycopyrronium (70-80 mL, giá trị p <0,001) và tiotropium (60-80 mL, giá trị p <0,001) [SPARK]. Trong [FLAME], thể tích FEV1 trung bình trước khi dùng thuốc của nhóm dùng Ultibro Breezhaler vượt trội hơn có ý nghĩa lâm sàng và có ý nghĩa thống kê ở tất cả các lần thăm khám tối đa 52 tuần so với nhóm dùng fluticasone / salmeterol (62-86 mL, p <0,001).
Dung tích đỉnh FEV1
Ultibro Breezhaler làm cải thiện có ý nghĩa thống kê dung tích đỉnh FEV1 khi so sánh với giả dược trong 4 giờ đầu sau khi dùng thuốc ở ngày 1 (210 mL, p<0,001), ở tuần 26 (330 mL, p<0,001), so sánh với indacaterol (120 mL), glycopyrronium (130 mL), tiotropium (130 mL) ở tuần 26 (p<0,001 trong tất cả các so sánh) [SHINE], và so sánh với fluticasone/salmeterol trong ngày 1 (70 mL, p<0,001) và tuần 26 (150 mL, p<0,001) [ILLUMINATE].
FEV1, AUC
Ultibro Breezhaler làm tăng FEV1, AUC-12 (tiêu chí đánh giá chính) sau khi dùng thuốc thêm 140 mL (p<0,001) so với fluticason/salmeterol đánh giá tại tuần thứ 26 trong nghiên cứu có thuốc đối chứng [ILLUMINATE].
Tác dụng khởi phát
Trong các nghiên cứu [SHINE và ILLUMINATE], Ultibro Breezhaler thể hiện tác dụng khởi phát nhanh làm giãn phế quản có ý nghĩa thống kê tại ngày 1 và tuần 26.
Bảng 3 Tác dụng khởi phát của thuốc so với giả dược, tiotropium và fluticasone/salmeterol ở phút thứ 5 và phút thứ 30 tại ngày 1 và tuần 26
| Ngày 1 | Tuần 26 | |
| So với giả dược | ||
| 5 phút | 130 mL* | 290 mL* |
| 30 phút | 200 mL* | 320 mL* |
| So với tiotropium | ||
| 5 phút | 70 mL* | 120 mL* |
| 30 phút | 90 mL* | 140 mL* |
| So với fluticasone/salmeterol | ||
| 5 phút | 80 mL* | 150 mL* |
| 30 phút | 80 mL* | 160 mL* |
| * p < 0,001 với tất cả các thuốc đối chiếu | ||
Đo khí dung liên tục
Trong nghiên cứu 26 tuần có đối chứng giả dược [SHINE], đo khí dung liên tục trong 12 giờ được thực hiện trong ngày thứ nhất (Hình 1) và khí dung liên tục 24 giờ ở tuần 26 (Hình 2) trong một nhóm gồm 294 bệnh nhân. Giá trị FEV, liên tục trong 12 giờ ở ngày thứ nhất và giá trị FEV1 đáy ở ngày thứ 2 được trình bày ở Hình 1 và ở tuần 26 trong Hình 2. Cải thiện chức năng phổi được duy trì trong vòng 24 giờ sau khi dùng liều đầu tiên và tiếp tục duy trì trong 26 tuần điều trị mà không có biểu hiện gì về dung nạp thuốc.
Hình 1 Dữ liệu 24 giờ của giá trị trung bình bình phương tối thiểu của FEV, (L) ở ngày 1 (phân tích toàn bộ, đo khí dung liên tục)

Hình 2 Giá trị trung bình bình phương tối thiểu của FEV, (L) đánh giá ở thời điểm 23 giờ 45 phút ở tuần 26 sau khi dùng thuốc (phân tích toàn bộ, đo khí dung liên tục)

Trong nghiên cứu [SHINE] đo khí dung liên tiếp, Ultibro Breezhaler thể hiện hiệu quả cải thiện FEV1 có ý nghĩa thống kê so với giả dược (400 mL, p<0.001) và tiotropium (160 mL, p<0.001) ở thời điểm 2 giờ sau khi dùng thuốc ở tuần 26.
Ultibro Breezhaler cũng làm cải thiện FEV, có ý nghĩa lâm sàng và có ý nghĩa thống kê khi so sánh với fluticasone/salmeterol tại tất cả các mốc thời gian từ 5 phút sau khi dùng thuốc đến 12 giờ sau khi dùng thuốc cả tuần 12 (p<0,001) và tuần 26 (p<0,001) [ILLUMINATE] (xem Hình 3).
Hình 3 Dữ liệu giá trị trung bình bình phương tối thiểu của FEV1 (L) từ 5 phút đến 12 giờ sau khi dùng thuốc ở tuần 12 và tuần 26 (Phân tích toàn bộ)

Kết quả điều trị về mặt triệu chứng Khó thở
Ultibro Breezhaler làm giảm đáng kể khó thở được đánh giá bằng chỉ số khó thở chuyển tiếp (Transitional Dyspnoea Index -TDI). Ultibro Breezhaler cho thấy tác dụng cải thiện có ý nghĩa lâm sàng và ý nghĩa thống kê trong một số điểm TDI chính ở tuần 26 khi so sánh với giả dược (1,09; p<0,001), tiotropium (0,51; p=0,007) [SHINE], và fluticasone/salmeterol (0,76; p=0,003) [ILLUMINATE].
Tỷ lệ cao hơn rõ rệt được ghi nhận trên bệnh nhân dùng Ultibro Breezhaler đáp ứng ở mức độ 1 điểm hoặc với mức độ cải thiện lớn hơn trong điểm TDI chính ở tuần 26 khi so sánh với giả dược (tương ứng 68,1% và 57,5%. p=0,004). Tỷ lệ bệnh nhân đáp ứng cao hơn phản ánh sự khác biệt có ý nghĩa lâm sàng ở tuần 26 dùng Ultibro Breezhaler khi so sánh với tiotropium (68,1% Ultibro Breezhaler so với 59,2% tiotropium, p=0,016) [SHINE] và fluticasone/salmeterol (65,1% Ultibro Breezhaler so với 55,5% fluticasone/salmeterol, p=0,088) [ILLUMINATE].
Sức khỏe liên quan đến chất lượng cuộc sống
Sử dụng Ultibro Breezhaler một lần/ngày cũng cho thấy hiệu quả khác biệt có ý nghĩa thống kê trên sức khỏe bệnh nhân liên quan đến chất lượng cuộc sống đo lường thông qua bộ câu hỏi về hô hấp St. George (SGRQ) ở tuần 26 thể hiện ở việc giảm tổng số điểm SGRQ khi so với nhóm giả dược (-3,01; p=0,002) và tiotropium (-2,13; p=0,009) [SHINE] và ở tuần 64 so sánh với tiotropium (-2,69; p<0,001) [SPARK], và ở 52 tuần so với fluticasone/salmeterol (-1,3; p=0,003) [FLAME] Ngoài ra, khả năng cải thiện điểm trong các tiêu chí của SGRQ “triệu chứng”, “vận động” và “ảnh hưởng trên hoạt động hàng ngày” đều có ý nghĩa thống kê khi so sánh với tiotropium ở tuần 64 (“triệu chứng”: -3,06; p=0,003, “vận động”: -3,14; p<0,001, “ảnh hưởng trên hoạt động hàng ngày”: -2,24; p=0,008) [SPARK],
Bệnh nhân dùng Ultibro Breezhaler có tỷ lệ có đáp ứng có ý nghĩa lâm sàng cao hơn trong việc cải thiện điểm SGRQ (được định nghĩa làm giảm ít nhất 4 đơn vị so với ban đầu) ở tuần 26 khi so sánh với giả dược (tương ứng 63,7% và 56,6%, p=0,088) và tiotropium (63,7% Ultibro Breezhaler so với 56,4% tiotropium, p=0,047) [SHINE] và ở tuần 64 so sánh với glycopyrronium và tiotropium (57,3% Ultibro Breezhaler so với 51,8% glycopyrronium; p=0,055; so với 50,8% tiotropium; p=0,051; tương ứng) [SPARK] và tại tuần 52 so với fluticasone/salmeterol (49,2% Ultibro Breezhaler và 43,7% fluticasone/salmeterol, tỉ số chênh: 1,30, p<0,001) [FLAME).
Hoạt động hàng ngày
Ultibro Breezhaler thể hiện hiệu quả cải thiện vượt trội có ý nghĩa thống kê so với tiotropium trên tỷ lệ phần trăm “số ngày có thể thực hiện các hoạt động hàng ngày bình thường” trong vòng 26 tuần (8,45%; p<0,001) [SHINE] và cho thấy sự cải thiện vượt trội hơn glycopyrronium về mặt số lượng (1,87; p=0,195) và cải thiện có ý nghĩa thống kê so với tiotropium (4,95; p=0,001) [SPARK).
Đợt cấp của bệnh phổi tắc nghẽn mạn tính (COPD)
Ở tuần 64 trong nghiên cứu [SPARK], Ultibro Breezhaler dùng một lần trong ngày làm giảm 12% tỷ lệ các đợt cấp của COPD ở mức độ trung bình hoặc nặng khi so sánh với glycopyrronium (p=0,038) và 10% khi so sánh với tiotropium (p=0,096).
Hơn nữa, Ultibro Breezhaler thể hiện hiệu quả vượt trội hơn có ý nghĩa lâm sàng và ý nghĩa thống kê so với glycopyrronium và tiotropium trong việc làm giảm tỷ lệ tất cả các đợt cấp của COPD (nhẹ, trung bình và nặng), với tỷ lệ giảm 15% đối với Ultibro Breezhaler khi so sánh với glycopyrronium (p=0,001) và 14% khi so sánh với tiotropium (p=0,002).
Với thời gian xuất hiện đợt cấp đầu tiên của COPD ở mức độ trung bình hoặc nặng, Ultibro Breezhaler làm giảm 7% nguy cơ khi so sánh với glycopyrronium (p=0,319).
Phối hợp glycopyrronium và tiotropium không có sự khác biệt về khả năng làm giảm nguy cơ.
Trong nghiên cứu đối chứng kéo dài 52 tuần (FLAME], Ultibro Breezhaler một lần trong ngày đã đạt được mục tiêu nghiên cứu đầu tiên về tỷ lệ tất cả các đợt cấp của COPD (nhẹ, trung bình hoặc nặng) không thấp hơn so với fluticasone/salmeterol. Ultibro Breezhaler cho thấy sự vượt trội trong việc làm giảm tỷ lệ đợt cấp của mỗi đợt là 11% so với fluticasone/salmeterol (3,59 so với 4,03; p=0,003) và kéo dài thời gian đợt cấp đầu tiên với giảm 16% nguy cơ đợt cấp (thời gian trung bình: 71 ngày đối với Ultibro Breezhaler và 51 ngày đối với fluticasone salmeterol, p <0,001).
Ultibro Breezhaler làm giảm tỷ lệ đợt cấp trung bình hoặc nặng giảm 17% so với fluticasone/salmeterol (0,98 30 với 1,19; p <0,001) và kéo dài thời gian đợt cấp trung bình hoặc nặng đầu tiên với giảm 22% nguy cơ đợt cấp (bách phân vị thứ 25: 127 ngày đối với Ultibro Breezhaler so với 87 ngày đối với fluticasone/salmeterol, p<0,001). Dưới 50% bệnh nhân trong nhóm Ultibro Breezhaler đã bị đợt cấp, do vậy thời gian đợt cấp trên bệnh nhân trung bình và nặng trong phần tư phần trăm đầu tiên đã được tính toán thay thế.
Ultibro Breezhaler làm giảm tỉ lệ đợt cấp nặng hàng năm là 13% so với fluticasone/salmeterol (0,15 so với 0,17, p = 0,231). Ultibro Breezhaler kéo dài thời gian đợt cấp nặng đầu tiên với giảm 19% nguy cơ đợt cấp (p = 0,046). Tỷ lệ viêm phổi (được xác nhận bằng chụp ảnh X quang, ví dụ chụp X quang ngực hoặc chụp CT) là 3,2% ở nhóm Ultibro Breezhaler so với 4,8% ở nhóm fluticasone/salmeterol (p = 0,017). Thời gian đến đợt viêm phổi đầu tiên được kéo dài bằng Ultibro Breezhaler so với fluticasone/salmeterol (p = 0,013).
Sử dụng thuốc cắt cơn
Trong vòng 26 tuần, Ultibro Breezhaler dùng một lần trong ngày làm giảm đáng kể số lần dùng thuốc cắt cơn (salbutamol) là 0,96 nhát/ngày (p<0,001) khi so sánh với giả dược và 0,54 nhát/ngày (p<0,001) khi so sánh với tiotropium nghiên cứu [SHINE], đồng thời giảm 0,39 nhát/ngày (p=0,019) khi so sánh với fluticasone/salmeterol nghiên cứu [ILLUMINATE].
Trong vòng 64 tuần, Ultibro Breezhaler làm giảm số lần dùng thuốc cắt cơn (salbutamol) là 0,76 nhát/ngày (p<0,001) khi so sánh với tiotropium trong nghiên cứu [SPARK].
Trong vòng 52 tuần, Ultibro Breezhaler dùng một lần trong ngày làm giảm việc sử dụng thuốc cắt cơn là 1,01 nhát/ngày từ mức ban đầu và fluticasone/salmeterol đã giảm 0,76 nhát/ngày từ mức ban đầu. Chênh lệch 0,25 nhát một ngày có ý nghĩa thống kê (p<0,001).
Khả năng gắng sức
Trong một nghiên cứu kéo dài 3 tuần [BRIGHT] khả năng gắng sức được thực hiện thông qua đo lường tải lực gắng sức gần cực đại (75%) (thử nghiệm khả năng gắng sức cực đại), Ultibro Breezhaler sử dụng vào buổi sáng, làm giảm thổi phồng động lực và cải thiện được thời gian gắng sức, tác dụng này được duy trì ngay từ liều đầu tiên. Trong ngày đầu điều trị, chức năng hô hấp trong điều kiện gắng sức được cải thiện có ý nghĩa (250 mL, p<0,001) khi so sánh với giả dược. Sau 3 tuần điều trị, mức độ cải thiện về dung tích hít vào khi dùng Ultibro Breezhaler cao hơn (320 mL, p<0,001) và thời gian gắng sức chịu được tăng lên (59,5 giây, p=0,006) khi so sánh với giả dược. Xu hướng tác dụng tương tự đã được ghi nhận với tiotropium.
Thăm dò dung tích phổi toàn thân xác định dung tích cặn (RV) và dung tích cặn chức năng (FRC) cho phép đánh giá chức năng đường dẫn khí và phản ánh sự tồn tại của khả năng nắm bắt khí, đặc trưng quan trọng của COPD. Trong ngày điều trị đầu tiên, sau khi dùng thuốc 60 phút, Ultibro Breezhaler làm giảm RV là 380 mL (p<0,001) khi so sánh với giả dược và FRC là 350 mL (p<0,001) khi so sánh với giả dược. Vào ngày thứ 21, 60 phút sau khi dùng thuốc, tiếp tục làm giảm 520 mL với RV (p<0,001) và 520 mL với FRC (p<0,001).
Thông tin liên quan đến Ultibro Breezhaler
Chương trình thử độc tính bắc cầu được thực hiện với Ultibro Breezhaler bao gồm đánh giá dược lý an toàn in vitro và in vivo, các nghiên cứu về độc tính dạng hít được thực hiện trong 2 tuần trên chuột cống và chó, nghiên cứu độc tính dạng hít trong 13 tuần trên chó và nghiên cứu ảnh hưởng của dạng hít lên sự phát triển của bào thai-thai nhi trên chuột cống. Tác dụng tăng nhịp tim rõ ràng sau khi dùng riêng từng thành phần và Ultibro Breezhaler trong các nghiên cứu về an toàn dược lý tim mạch hoặc các nghiên cứu về độc tính liều lặp lại thực hiện trên chó.
Ảnh hưởng trên nhịp tim của Ultibro Breezhaler thể hiện ở tăng về mức độ và thời gian duy trì tăng khi so sánh với những thay đổi quan sát được khi dùng từng thành phần đơn lẻ thống nhất với tác dụng hiệp đồng cộng của hai thành phần. Trong một nghiên cứu độc tính kéo dài 2 tuần trên chó, sử dụng liều cao nhất của indacaterol đơn độc hoặc phối hợp trong Ultibro Breezhaler, tổn thương cơ nhú trên tim trên một vài cá thể đã được ghi nhận tương tự về tần suất xuất hiện và mức độ nghiêm trọng.
Rút ngắn khoảng PR, độ rộng sóng P, khoảng QT phản ánh sự tăng nhịp tim và giảm huyết áp tâm thu và huyết áp tâm trương cũng đã được ghi nhận sau khi điều trị bằng Ultibro Breezhaler trong nghiên cứu độ an toàn dược lý tim mạch được thực hiện trên chó. Đánh giá biên độ an toàn dựa trên tổn thương cơ nhủ trên tim chó là loài nhạy cảm nhất đã được thực hiện.
Trong nghiên cứu độc tính kéo dài 13 tuần kết quả cho thấy mức liều không ghi nhận được biến cố bất lợi (NOAEL) là 0,386/0,125 mg/kg/ngày (tính theo indacaterol/glycopyrronium), không ghi nhận được tổn thương tim tương đương với nồng độ thuốc toàn thân dựa trên giá trị AUCO-24h, cao hơn xấp xỉ khoảng 59 đến 64 lần so với giá trị ghi nhận được trên người sử dụng mức liều 110/50 microgram tương ứng cho mỗi thành phần (indacaterol/glycopyrronium).
Thông tin liên quan đến indacaterol
Các dữ liệu phi lâm sàng cho thấy thuốc có nguy hại đặc biệt trên người dựa trên các nghiên cứu thường quy về dược lý an toàn, độc tính liều lặp lại, độc tính trên gen, khả năng gây ung thư và độc tính trên sinh sản. Ảnh hưởng của indacaterol quan sát được trong các nghiên cứu về độc tính trên chó chủ yếu trên hệ tim mạch bao gồm nhịp nhanh, loạn nhịp và tổn thương cơ tim.
Các tác động này đã được biết đến là tác dụng dược lý và có thể được giải thích bằng tác dụng đồng vận beta, của indacaterol. Các tác động đáng chú ý khác trong nghiên cứu độc tính liều lặp lại bao gồm kích ứng nhẹ đường hô hấp trên của chuột bao gồm viêm mũi và biến đổi biểu mô khoang mũi và thanh quản. Toàn bộ các kết quả này được quan sát ở nồng độ được cho là đủ cao hơn hơn nồng độ tối đa trên người cho thấy ít liên quan đến việc sử dụng lâm sàng.
Các biến cố bất lợi liên quan đến khả năng sinh sản, mang thai, sự phát triển của bào thai/thai nhi, sự phát triển trước và sau khi sinh chỉ ghi nhận được ở mức liều cao hơn 500 lần mức liều hít hàng ngày 150 microgram trên người (dựa trên AUCO-24h).
Các tác động, cụ thể là gia tăng sự thay đổi về xương đã được quan sát thấy trên thỏ. Indacaterol không gây quái thai trên chuột hoặc thỏ sau khi dùng đường tiêm dưới da. Các nghiên cứu về độc tính trên gen không cho thấy bất cứ khả năng gây đột biến hoặc clastogenic nào. Khả năng sinh ung thư của indacaterol được đánh giá trong nghiên cứu dạng hít kéo dài 2 năm trên chuột và nghiên cứu dạng uống trên chuột chuyển gen trong 26 tuần.
Điều trị trên chuột cống suốt đời làm tăng nguy cơ xuất hiện khối u cơ trơn buồng trứng lành tính và tăng sản khu trú cơ trơn buồng trứng ở liều gấp khoảng 30 lần liều 150 microgram dùng ngày một lần trên người (dựa trên AUCO-24h). Nguy cơ gây tăng tần suất xuất hiện khối u cơ trơn đường sinh dục chuột cái cũng đã được chứng minh với các thuốc đồng vận beta2-adrenergic khác.
Nghiên cứu đường uống 26 tuần trên chuột nhắt mang gen CB6F1/TgrasH2 với indacaterol không chỉ ra bất cứ bằng chứng nào về khả năng gây ung thư ở mức liều gấp ít nhất 103 lần mức liều 150 microgram một lần/ngày trên người (trên cơ sở AUCO-24h).
Thông tin liên quan đến glycopyrronium
Các dữ liệu phi lâm sàng cho thấy thuốc không gây nguy hại trên người dựa trên các nghiên cứu thường quy về dược lý an toàn, độc tính liều lặp lại, độc tính trên gen, khả năng gây ung thư và độc tính trên sinh sản và phát triển.
Tác động được ghi nhận trong nghiên cứu độc tính dạng hít liều lặp liên quan đến sự gia tăng các tác dụng dược lý đã định trước của glycopyrronium hoặc kích ứng nhẹ tại chỗ. Các tác động này bao gồm tăng nhẹ đến trung bình nhịp tim trên chó và một số thay đổi có hồi phục trên chuột cống và chó liên quan đến giảm tiết từ các tuyến nước bọt, tuyến lệ và tuyến Harderian và cổ họng.
Đục thủy tinh thể được quan sát thấy trong nghiên cứu mạn tính trên chuột cống cũng đã được mô tả với các thuốc kháng muscarinic khác và được xem như là sự thay đổi đặc hiệu cho loài, ít liên quan đến việc điều trị trên bệnh nhân.
Các ảnh hưởng trên đường hô hấp của chuột cống bao gồm biến đổi thoái hóa/ tái sinh và viêm khoang mũi và thanh quản thống nhất với sự kích thích nhẹ tại chỗ. Sự thay đổi nhỏ tế bào biểu mô phổi tại ngã ba tiểu phế quản phế nang cũng được quan sát thấy trên chuột cống và được xem như phản ứng thích nghi nhẹ. Toàn bộ các kết quả này được quan sát ở nồng độ được cho là đủ cao hơn hơn nồng độ tối đa trên người cho thấy ít có liên quan đến việc sử dụng lâm sàng.
Các nghiên cứu độc tính trên gen không cho thấy nguy cơ gây đột biến gen hoặc clastogenic của glycopyrronium. Các nghiên cứu về khả năng sinh ung thư trên chuột nhắt chuyển gen dùng đường uống và trên chuột cống sử dụng đường hít không cho thấy bằng chứng về khả năng gây ung thư ở nồng độ toàn thân (AUCO-24h) cao hơn khoảng 53 lần trên chuột nhắt và 75 lần trên chuột cống so với liều 50 microgram một lần/ngày trên người.
Các dữ liệu được công bố về glycopyrronium không cho thấy bất cứ độc tính nào liên quan đến khả năng sinh sản. Glycopyrronium không gây quái thai trên chuột cống hoặc thỏ sau khi dùng đường hít. Các nghiên cứu về khả năng sinh sản trên chuột cống và các dữ liệu khác trên động vật không cho thấy có mối liên quan đến khả năng sinh sản trên cả giống đực và giống cái hoặc quá trình phát triển trước và sau khi sinh.
Glycopyrronium và chất chuyển hóa của nó ít qua hàng rào nhau thai trên chuột nhắt, thỏ và chó mang thai. Glycopyrronium (bao gồm cả các chất chuyển hóa của nó) được bài tiết vào sữa trên chuột cống đang cho con bú và đạt nồng độ trong sữa cao hơn đến 10 lần trong máu chuột mẹ.
Mục lục
Toggle Hộp 1 lọ x 15ml
Hộp 1 lọ x 15ml Hộp 10 vỉ x 10 viên
Hộp 10 vỉ x 10 viên Hộp 1 chai x 30ml
Hộp 1 chai x 30ml Hộp 20 gói x 5ml
Hộp 20 gói x 5ml Hộp 2 vỉ x 10 viên
Hộp 2 vỉ x 10 viên Hộp 1 chai x 100ml
Hộp 1 chai x 100ml











Chưa có đánh giá nào.