Ferricyanide (Kali Ferricyanide): Công Dụng, Ứng Dụng & Lưu Ý An Toàn
Tổng hợp chi tiết về Ferricyanide (Kali Ferricyanide): thành phần, cơ chế, ứng dụng trong công nghiệp, nhiếp ảnh, y tế, và hướng dẫn sử dụng an toàn. Bài viết chuẩn SEO, cập nhật thông tin đa nguồn.
Giới Thiệu về Ferricyanide
Thành Phần & Tính Chất Hóa Học
Phương Pháp Điều Chế & Sản Xuất
Ứng Dụng Thực Tế
Rủi Ro & Lưu Ý An Toàn
Câu Hỏi Thường Gặp (FAQ)
Kết Luận
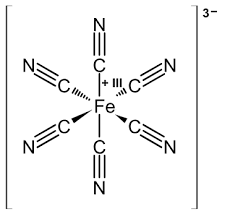
Ferricyanide là một ion phức có công thức hóa học [Fe(CN)₆]³⁻, thường tồn tại dưới dạng muối kali (K₃[Fe(CN)₆]) – Kali Ferricyanide. Hợp chất này được phát hiện năm 1822 bởi Leopold Gmelin và nổi bật với màu đỏ đậm, tan tốt trong nước 28.
Khác với Ferrocyanide ([Fe(CN)₆]⁴⁻), Ferricyanide chứa sắt ở trạng thái oxy hóa +3, mang tính oxy hóa mạnh, ứng dụng rộng rãi trong công nghiệp, nhiếp ảnh, và nghiên cứu hóa học 29.
Công thức hóa học: K₃[Fe(CN)₆] 23.
Khối lượng mol: 329.24 g/mol 810.
Cấu trúc tinh thể: Dạng đơn nghiêng, ion Fe³+ liên kết bát diện với 6 nhóm cyanide (CN⁻), tạo mạng polyme phức tạp cùng ion K+ 28.
Màu sắc: Tinh thể đỏ đậm hoặc bột màu cam đến đỏ thẫm 27.
Độ tan: 464 g/L ở 20°C, tăng lên 775 g/L trong nước nóng 28.
Nhiệt độ nóng chảy: ~300°C (phân hủy khi đun sôi) 810.
Oxy hóa mạnh: Tham gia phản ứng oxy hóa-khử, đặc biệt trong môi trường axit.
Phân hủy nguy hiểm: Khi tiếp xúc với axit đậm đặc, giải phóng khí HCN độc hại 810.
Oxy hóa Kali Ferrocyanide:
Sử dụng khí Clo hoặc Kali Dichromate (K₂Cr₂O₇) để oxy hóa K₄[Fe(CN)₆] thành K₃[Fe(CN)₆]:
2K₄[Fe(CN)₆] + Cl₂ → 2K₃[Fe(CN)₆] + 2KCl 27.
Điện Phân: Điện phân dung dịch Kali Ferrocyanide để chuyển Fe²+ → Fe³+ 7.
Châu Âu: Đức, Pháp – ứng dụng trong công nghiệp hóa chất và nghiên cứu 7.
Châu Á: Trung Quốc, Ấn Độ, Việt Nam – tập trung vào xử lý nước và sản xuất thuốc nhuộm 7.
Cyanotype: Kết hợp với Sắt Amoni Citrate tạo phản ứng quang hóa, dùng in bản vẽ kỹ thuật (blueprint) 26.
Xử lý phim ảnh:
Giảm mật độ ảnh (Farmer’s Reducer): Pha với Natri Thiosunfat để làm sáng vùng tối trên phim đen trắng 28.
Tẩy bạc: Loại bỏ lớp bạc thừa khỏi âm bản màu 810.
Mạ điện: Làm chất điện phân trong mạ đồng, sắt 8.
Chất oxy hóa hữu cơ: Tham gia tổng hợp hợp chất hữu cơ, ví dụ Sharpless dihydroxyl hóa 8.
Cảm biến sinh học: Ứng dụng trong thiết bị đo đường huyết, thay thế oxy để vận chuyển điện tử với enzyme glucose oxidase 38.
Phát hiện sắt trong mô: Phản ứng với Fe²+ tạo Prussian Blue (xanh Turnbull), dùng trong xét nghiệm mô học 8.
Đo khả năng khử oxy hóa: Đánh giá hoạt tính chống oxy hóa của mẫu sinh học 8.
Giải phóng HCN: Khi tiếp xúc với axit mạnh (vd: H₂SO₄), phản ứng tạo khí hydro cyanide cực độc:
6H⁺ + [Fe(CN)₆]³⁻ → 6HCN + Fe³+ 810.
Kích ứng: Gây kích ứng da/mắt nếu không dùng đồ bảo hộ 10.
Bảo hộ cá nhân: Đeo găng tay, kính mắt, và khẩu trang khi pha chế 10.
Bảo quản: Nơi khô ráo, tránh ánh sáng và nhiệt độ cao 710.
Xử lý sự cố: Rửa sạch với nước nếu tiếp xúc da; thông gió khu vực nhiễm HCN 8.
Q1: Ferricyanide và Ferrocyanide khác nhau như thế nào?
A: Ferricyanide chứa Fe³+ ([Fe(CN)₆]³⁻), có tính oxy hóa mạnh. Ferrocyanide chứa Fe²+ ([Fe(CN)₆]⁴⁻), ổn định hơn và ít độc 29.
Q2: Kali Ferricyanide có độc không?
A: Ít độc ở dạng muối, nhưng nguy hiểm khi tiếp xúc axit do sinh HCN. LD50 trên chuột là 2970 mg/kg 810.
Q3: Ứng dụng thực tế nhất của Ferricyanide?
A: Trong nhiếp ảnh (xử lý phim) và công nghiệp mạ điện 28.
Ferricyanide, đặc biệt là Kali Ferricyanide, là hợp chất đa năng với vai trò quan trọng trong công nghiệp, y tế, và nghệ thuật. Tuy nhiên, cần tuân thủ nghiêm ngặt các biện pháp an toàn do tiềm ẩn rủi ro giải phóng HCN. Khi mua sản phẩm, nên chọn nhà cung cấp uy tín như VietBioLab hoặc KDC Chemical để đảm bảo chất lượng và nguồn gốc rõ ràng 17.
Ferricyanide, Kali Ferricyanide, ứng dụng Ferricyanide, cấu tạo Kali Ferricyanide, an toàn khi dùng Ferricyanide.

