Nitrogen: Khí Trơ Quan Trọng Trong Tự Nhiên Và Ứng Dụng Công Nghiệp
Khám phá Nitrogen (Nitơ) – nguyên tố chiếm 78% khí quyển, vai trò sinh học, ứng dụng công nghiệp, tác động môi trường và những điều thú vị ít người biết. Thông tin khoa học chi tiết từ A-Z!
Tổng Quan Về Nitrogen
Đặc Tính Hóa Học Và Vật Lý
Vai Trò Sinh Học Của Nitrogen
Chu Trình Nitrogen Trong Tự Nhiên
Ứng Dụng Công Nghiệp Của Nitrogen
Nitrogen Trong Nông Nghiệp Và Sản Xuất Phân Bón
Nitrogen Lỏng Và Ứng Dụng Y Tế
Tác Động Tiêu Cực Của Nitrogen Đến Môi Trường
Cách Sử Dụng Và Bảo Quản Nitrogen An Toàn
Nghiên Cứu Mới Về Nitrogen
Câu Hỏi Thường Gặp (FAQ)
Kết Luận
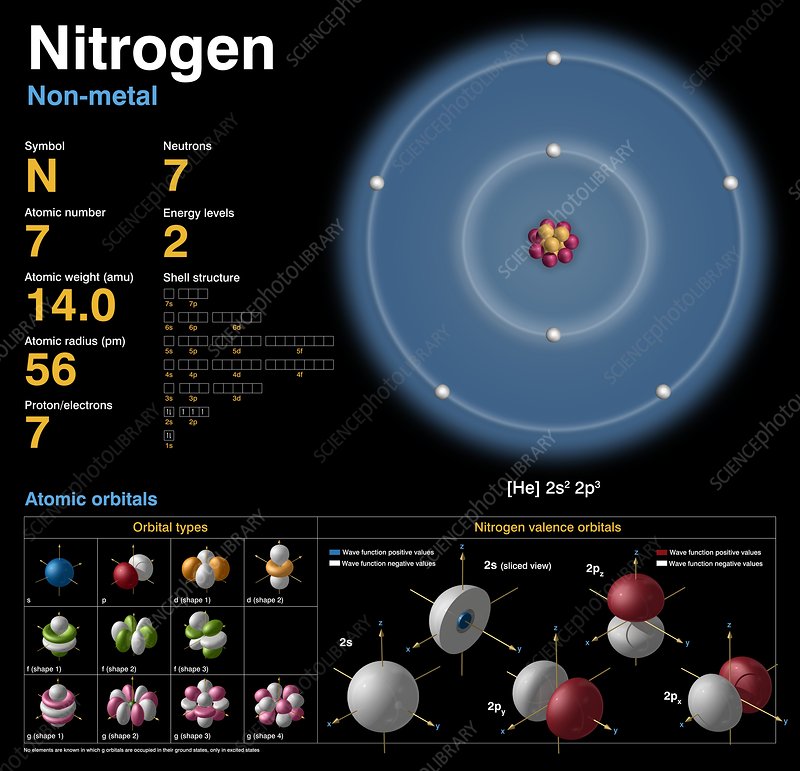
Nitrogen (ký hiệu hóa học N) là nguyên tố hóa học phong phú nhất trong khí quyển Trái Đất, chiếm 78% thể tích không khí. Là thành phần không thể thiếu của sự sống, Nitrogen tham gia vào cấu trúc protein, DNA và nhiều hợp chất hữu cơ khác.
Trạng Thái Tự Nhiên: Tồn tại chủ yếu ở dạng khí N₂, Nitrogen lỏng và hợp chất (amoniac, nitrate…).
Phát Hiện: Được Daniel Rutherford phát hiện năm 1772.
Đặc Điểm Nổi Bật: Khí trơ, không màu, không mùi, khó phản ứng ở điều kiện thường.
Nitrogen đóng vai trò sống còn trong nông nghiệp, công nghiệp và công nghệ sinh học, nhưng cũng tiềm ẩn rủi ro nếu tích tụ quá mức trong môi trường.
Tính Chất Vật Lý:
Khối Lượng Nguyên Tử: 14,007 u.
Điểm Nóng Chảy: -210°C.
Điểm Sôi: -196°C.
Mật Độ: 1,25 g/L (ở 0°C).
Tính Chất Hóa Học:
Độ Âm Điện: 3,04 (thang Pauling).
Liên Kết Ba Trong N₂: Liên kết cực kỳ bền (năng lượng liên kết 945 kJ/mol), khiến N₂ khó phản ứng.
Phản Ứng Đặc Trưng: Chỉ phản ứng ở nhiệt độ cao hoặc có xúc tác (ví dụ: tổng hợp amoniac trong công nghiệp).
Nitrogen là thành phần thiết yếu của:
Protein và Axit Amin: Tham gia cấu trúc tế bào, enzyme, hormone.
DNA và RNA: Xây dựng nucleotide (adenine, guanine).
Chất Diệp Lục (Chlorophyll): Giúp thực vật quang hợp.
Quá Trình Cố Định Nitrogen:
Vi Khuẩn Cố Định Đạm (Rhizobium): Chuyển hóa N₂ thành NH₃ trong rễ cây họ đậu.
Sấm Sét: Tạo phản ứng đốt cháy N₂ và O₂ tạo nitrate (NO₃⁻), cung cấp đạm cho đất.
Chu trình Nitrogen gồm 5 giai đoạn chính:
Cố Định Nitrogen: Chuyển N₂ thành NH₃ hoặc NO₃⁻.
Đồng Hóa: Thực vật hấp thụ NH₄⁺ và NO₃⁻.
Dị Hóa: Phân hủy xác sinh vật thành amoniac.
Nitrat Hóa: Chuyển NH₄⁺ thành NO₃⁻ nhờ vi khuẩn Nitrosomonas và Nitrobacter.
Phản Nitrat Hóa: Chuyển NO₃⁻ thành N₂, giải phóng trở lại khí quyển.
Tầm Quan Trọng: Duy trì cân bằng dinh dưỡng trong hệ sinh thái.
Công Nghiệp Hóa Chất:
Sản xuất amoniac (NH₃) → Nguyên liệu cho phân bón, thuốc nổ.
Tổng hợp nitric acid (HNO₃) → Sản xuất nhựa, dược phẩm.
Bảo Quản Thực Phẩm:
Khí Nitrogen làm chậm oxy hóa, kéo dài thời gian sử dụng.
Công Nghiệp Điện Tử:
Tạo môi trường trơ trong sản xuất linh kiện bán dẫn.
Hàn Và Cắt Kim Loại:
Ngăn chặn phản ứng oxy hóa khi hàn.
Phân Đạm (Ure, Ammonium Nitrate): Cung cấp Nitrogen cho cây trồng, tăng năng suất 30–50%.
Thách Thức: Lạm dụng phân bón dẫn đến ô nhiễm nước ngầm (NO₃⁻ vượt ngưỡng).
Giải Pháp Bền Vững:
Sử dụng phân bón hữu cơ.
Luân canh cây họ đậu để tận dụng vi khuẩn cố định đạm.
Bảo Quản Mẫu Sinh Học: Làm lạnh nhanh ở -196°C, ngăn tổn thương tế bào.
Điều Trị Da Liễu: Loại bỏ mụn cóc, tổn thương da bằng phương pháp áp lạnh.
Cảnh Báo An Toàn:
Gây bỏng lạnh nếu tiếp xúc trực tiếp.
Cần sử dụng thiết bị bảo hộ khi làm việc với Nitrogen lỏng.
Hiện Tượng Phú Dưỡng: Dư thừa nitrate (NO₃⁻) trong nước → Tảo nở hoa, suy giảm oxy, giết chết sinh vật thủy sinh.
Phát Thải Khí Nhà Kính:
N₂O (Nitrous Oxide) có khả năng giữ nhiệt gấp 265 lần CO₂.
Nguồn phát thải: Phân bón, chất thải chăn nuôi.
Giải Pháp: Kiểm soát sử dụng phân bón, xử lý nước thải nông nghiệp.
Bảo Quản Khí Nén: Trong bình thép, tránh nhiệt độ cao.
Vận Chuyển Nitrogen Lỏng: Dùng bình chân không chuyên dụng.
An Toàn Khi Sử Dụng:
Đeo kính bảo hộ, găng tay cách nhiệt.
Làm thoáng khu vực kín tránh ngạt khí.
Công Nghệ Xanh: Phát triển phương pháp cố định đạm tự nhiên thay thế quy trình Haber-Bosch tiêu tốn năng lượng (nghiên cứu ĐH Stanford, 2023).
Ứng Dụng Trong Năng Lượng: Pin Nitrogen giúp lưu trữ năng lượng tái tạo (dự án tại MIT).
Q1: Tại sao Nitrogen được gọi là “khí trơ”?
A: Do liên kết ba bền vững trong phân tử N₂ khiến nó khó phản ứng ở điều kiện thường.
Q2: Thực vật có hấp thụ được Nitrogen từ không khí không?
A: Không. Chúng cần vi khuẩn cố định đạm hoặc phân bón để chuyển N₂ thành dạng NH₄⁺/NO₃⁻.
Q3: Nitrogen lỏng có độc không?
A: Không độc, nhưng gây nguy hiểm do nhiệt độ cực thấp (-196°C).
Nitrogen là nguyên tố không thể thiếu cho sự sống và phát triển công nghiệp. Tuy nhiên, việc quản lý hiệu quả chu trình Nitrogen là chìa khóa để cân bằng sinh thái và phát triển bền vững. Hiểu rõ đặc tính, ứng dụng và rủi ro của Nitrogen giúp chúng ta khai thác tối ưu nguồn tài nguyên này!
Lưu ý: Nitrogen, khí Nitơ, ứng dụng Nitrogen, chu trình Nitơ, tác hại của Nitơ, Nitrogen lỏng.

