| Công dụng | Điều trị đột quỵ |
| Đối tượng sử dụng | Người lớn từ 18 tuổi trở lên |
| Mang thai & Cho con bú | Không được dùng |
| Cách dùng | Uống trong bữa ăn |
| Hoạt chất | Rivaroxaban |
| Danh mục | Thuốc kháng đông, chống kết dính tiểu cầu & tiêu sợi huyết |
| Thuốc kê đơn | Có |
| Xuất xứ | Việt Nam |
| Quy cách | Hộp 2 vỉ x 10 viên |
| Dạng bào chế | Viên nén bao phim |
| Thương hiệu | Hadiphar |
| Mã SKU | SP02267 |
| Hạn dùng | 36 tháng kể từ ngày sản xuất |
| Số đăng ký | VD-35980-22 |
Xabantk 15mg là thuốc điều trị dự phòng đột quỵ và thuyên tắc mạch toàn thân ở các bệnh nhân bị rung nhĩ không do bệnh lý van tim có một yếu tố nguy cơ hoặc nhiều hơn.
Nhà thuốc Bạch Mai cam kết

Thuốc Xabantk 15mg của Hadiphar., thành phần chính là Rivaroxaban. Xabantk 15mg là thuốc điều trị dự phòng đột quỵ và thuyên tắc mạch toàn thân ở các bệnh nhân bị rung nhĩ không do bệnh lý van tim có một yếu tố nguy cơ hoặc nhiều hơn.
Thành phần:
Rivaroxaban 15 mg
Tá dược: PVP K30, avicel PH 102, sodium starch glycolate (DST), aerosil, magnesi stearat, HPMC 606 CPS, HPMC 615 CPS, PEG 6000, titan dioxyd, carmoisin vừa đủ 1 viên.
Dạng bào chế: Viên nén bao phim.
Mô tả: Viên nén bao phim màu đỏ, cạnh và thành viên lành lặn.
Quy cách đóng gói: Hộp 2 vỉ x vì 7 viên, hộp 2 vỉ x vỉ 10 viên.
Được chỉ định để dự phòng đột quỵ và thuyên tắc mạch toàn thân ở các bệnh nhân bị rung nhĩ không do bệnh lý van tim có một yếu tố nguy cơ hoặc nhiều hơn như: suy tim, tăng huyết áp, từ 75 tuổi, đái tháo đường, tiền sử đột quỵ hoặc cơn thiếu máu hoại tử cục bộ thoáng qua.
Điều trị huyết khối tĩnh mạch sâu (DVT) và tắc mạch phổi (PE), và phòng ngừa DVT và PE tái phát ở người lớn.
Liều dùng
Phòng ngừa đột quỵ và thuyên tắc mạch toàn thân ở bệnh nhân rung nhĩ (SPAF)
Liều khuyến cáo là 20 mg ngày một lần, đó cũng là liều tối đa được khuyến cáo.
Việc điều trị với Rivaroxaban nên được tiếp tục trong thời gian dài với điều kiện lợi ích về dự phòng đột quỵ và thuyên tắc mạch toàn thân là vượt trội so với nguy cơ chảy máu (xem phần “Cảnh báo).
Nếu bệnh nhân quên uống một liều thuốc thì nên uống Rivaroxaban ngay khi nhớ ra và tiếp tục uống ngày 1 lần theo khuyến cáo vào ngày tiếp theo. Không nên dùng liều gấp đôi trong cùng một ngày để bù cho liều thuốc đã quên không uống.
Điều trị DVT, điều trị PE và phòng ngừa DVT và PE tái phát
Liều khuyến cáo cho điều trị ban đầu DVT hoặc PE cấp tính là 15 mg hai lần mỗi ngày trong ba tuần đầu, tiếp theo sau là 20 mg mỗi ngày một lần để tiếp tục điều trị và phòng ngừa DVT và PE tái phát.
Thời gian điều trị ngắn (ít nhất 3 tháng) nên được xem xét ở những bệnh nhân bị DVT hoặc PE bị kích thích bởi các yếu tố nguy cơ thoáng qua (ví dụ như phẫu thuật hoặc chấn thương lớn gần đây). Thời gian điều trị dài hơn nên được xem xét ở những bệnh nhân bị DVT hoặc PE bị kích thích không liên quan đến các yếu tố nguy cơ thoáng qua, DVT hoặc PE không được chứng minh, hoặc có tiền sử DVT hoặc PE tái phát.
Khi dự phòng kéo dài DVT và PE tái phát được chỉ định (sau khi hoàn thành ít nhất 6 tháng trị liệu cho DVT hoặc PE), liều khuyến cáo là 10 mg mỗi ngày một lần. Ở những bệnh nhân có nguy cơ DVT hoặc PE tái phát được coi là cao, chẳng hạn như những người mắc bệnh đi kèm phức tạp, hoặc đã phát triển DVT hoặc PE tái phát khi dự phòng kéo dài bằng Rivaroxaban 10 mg mỗi ngày một lần, nên xem xét dùng liều Rivaroxaban 20 mg mỗi ngày.
Thời gian điều trị và lựa chọn liều nên được cá nhân hóa sau khi đánh giá cần thận lợi ích điều trị chống lại nguy cơ chảy máu.
| Khoảng thời gian | Lịch trình | Tổng liều hàng ngày | |
| Điều trị và phòng ngừa DVT và PE tái phát | Ngày 1-21 | 15 mg hai lần mỗi ngày | 30 mg |
| Ngày 22 trở đi | 20 mg mỗi ngày một lần | 20 mg | |
| Phòng ngừa DVT và PE tái phát | Sau khi hoàn thành ít nhất 6 tháng trị liệu cho DVT hoặc PE | 10 mg mỗi ngày một lần hoặc 20 mg mỗi ngày | 10 mg hoặc 20 mg |
Nếu một liều bị bỏ qua trong giai đoạn điều trị 15 mg hai lần mỗi ngày (ngày 1 – 21), bệnh nhân nên dùng rivaroxaban ngay lập tức để đảm bảo lượng 30 mg rivaroxaban mỗi ngày. Trong trường hợp này, hai viên 15 mg có thể được uống cùng một lúc. Bệnh nhân nên tiếp tục dùng 15 mg đều đặn hai lần mỗi ngày theo khuyến cáo vào ngày hôm sau.
Nếu bỏ là một liều trong giai đoạn điều trị mỗi ngày một lần, bệnh nhân nên dùng rivaroxaban ngay lập tức, và tiếp tục vào ngày hôm sau với lượng dùng một lần mỗi ngày theo khuyến cáo. Không nên tăng gấp đôi liều trong cùng một ngày để bù cho liều đã quên.
Chuyển đổi từ kháng Vitamin K (VKA) sang Rivaroxaban
Đối với những bệnh nhân được điều trị dự phòng đột quỵ và thuyên tắc mạch toàn thân, nên ngừng điều trị VKA và bắt đầu điều trị bằng Rivaroxaban khi chỉ số (INR) ≤ 3.
Đối với những bệnh nhân được điều trị DVT, PE và phòng ngừa tái phát, nên ngừng điều trị VKA và nên bắt đầu điều trị bằng Rivaroxaban khi chỉ số INR ≤2,5
Khi chuyển từ VKA sang Rivaroxaban, giá trị INR sẽ bị tăng giả sau khi uống Rivaroxaban. Chỉ số INR không có giá trị để đo lường hoạt tính chống động máu của Rivaroxaban, và do đó không nên sử dụng.
Chuyển đổi từ Rivaroxaban sang các thuốc kháng Vitamin K (VKA)
Có khả năng chống đông máu không đầy đủ trong quá trình chuyển từ Rivaroxaban sang VKA. Cần phải đảm bảo chống đông liên tục đầy đủ trong bất kỳ quá trình chuyển đổi sang thuốc chống đông máu thay thế. Cần lưu ý rằng Rivaroxaban có thể góp phần làm chỉ số INR tăng cao.
Ở những bệnh nhân chuyển từ Rivaroxaban sang VKA, VKA nên được dùng đồng thời cho đến khi chỉ số INR là ≥ 2. Trong hai ngày đầu tiên của giai đoạn chuyển đổi, nên sử dụng liều VKA tiêu chuẩn ban đầu, sau đó là liều VKA dựa trên kết quả test INR. Khi bệnh nhân sử dụng đồng thời Rivaroxaban và VKA, nên kiểm tra chỉ số INR trước liều kế tiếp của Rivaroxaban nhưng phải sau 24 giờ so với liều trước đó. Sau khi ngừng Rivaroxaban, xét nghiệm INR có thể được thực hiện một cách đáng tin cậy ít nhất 24 giờ sau liều cuối cùng.
Chuyển đổi từ thuốc chống đông máu đường tiêm sang Rivaroxaban
Đối với những bệnh nhân hiện đang sử dụng thuốc chống đông máu đường tiêm, hãy ngừng sử dụng thuốc chống đông máu đường tiêm và bắt đầu sử
dụng Rivaroxaban từ 0 đến 2 giờ trước lần dùng tiếp theo của sản phẩm thuốc đường tiêm (ví dụ như sử dụng heparin trọng lượng phân tử thấp) hoặc ở thời điểm ngừng các thuốc truyền tĩnh mạch liên tục (ví dụ: heparin không phân đoạn truyền tĩnh mạch).
Chuyển đổi từ Rivaroxaban sang thuốc chống đông máu đường tiêm
Sử dụng liều thuốc chống đông máu đường tiêm liều đầu tiên tại thời điểm dùng liều Rivaroxaban tiếp theo.
Đối tượng đặc biệt
Suy thận
Dữ liệu lâm sàng cho bệnh nhân suy thân nặng (độ thanh thải creatinin 15 – 29 ml / phút) cho thấy nồng độ trong huyết tương của Rivaroxaban tăng
đáng kể. Do đó, Rivaroxaban phải được sử dụng thận trong ở những bệnh nhân này. Không nên sử dụng ở những bệnh nhân có độ thanh thải creatinin <15 ml / phút.
Ở những bệnh nhân suy thận vừa (độ thanh thải creatinin 30 – 49 ml / phút) hoặc nặng (độ thanh thải creatinin 15-29 ml / phút) suy thận áp dụng các khuyến nghị liễu sau
– Đế phòng ngừa đột quỵ và thuyền tắc hệ thống ở bệnh nhân rung tâm nhĩ không do van tim, liều khuyến cáo là 15 mg mỗi ngày một lần.
– Để điều trị DVT, điều trị PE và phòng ngừa DVT và PE tái phát bệnh nhân nên được điều trị với 15 mg hai lần mỗi ngày trong 3 tuần đầu. Sau đó, khi liều
khuyến cáo là 20 mg mỗi ngày một lần, nên giảm liều từ 20 mg mỗi ngày xuống còn 15 mg mỗi ngày nếu bệnh nhân đánh giá nguy cơ chảy máu cao hơn
nguy cơ DVT và PE tái phát. Khuyến cáo về việc sử dụng 15 mg dựa trên mô hình PK và chưa được nghiên cứu trong bối cảnh làm sàng này.
Khi liều khuyến cáo là 10 mg mỗi ngày một lần, không cần điều chỉnh liều từ liều khuyến cáo.
Không cần điều chỉnh liều ở bệnh nhân suy thận nhẹ (độ thanh thải creatinin 50 – 80 ml / phút).
Suy gan
Rivaroxaban chống chỉ định ở những bệnh nhân mắc bệnh gan liên quan đến rối loạn đông máu và nguy cơ chảy máu liên quan đến lâm sàng bao gồm cá bệnh nhân xơ gan Child Pugh B và C.
Người già
Không điều chỉnh liều.
Cân nặng cơ thể
Không điều chỉnh liều.
Giới tính
Không điều chỉnh liều
Trẻ em
Sự an toàn và hiệu quả của Rivaroxaban ở trẻ em từ 0 đến 18 tuổi chưa được thiết lập. Không có dữ liệu. Do đó, Rivaroxaban không được khuyến cáo sử dụng cho trẻ em dưới 18 tuổi.
Bệnh nhân cần chuyển nhịp
Rivaroxaban có thể được bắt đầu hoặc tiếp tục trên những bệnh nhân cần chuyển nhịp.
Đối với bệnh nhân chuyển nhịp dựa vào siêu âm qua thực quản mà không được điều trị kháng đồng trước đó, thì Rivaroxaban nên được bắt đầu ít nhất 4
giờ trước chuyển nhịp để đảm bảo hiệu quả kháng đông đầy đủ. Nên tìm hiểu xem bệnh nhân có sử dụng Rivaroxaban như trong đơn thuốc trước khi chuyển nhịp hay không cho tất cả các bệnh nhân. Việc quyết định khởi đầu và liệu trình điều trị nên được dựa vào các hướng dẫn điều trị kháng đông ở bệnh nhân chuyển nhịp.
Cách dùng
Các viên thuốc có thể được uống cùng hoặc không cùng thức ăn.
Đối với những bệnh nhân không thể nuốt cả viên, viên Xabantk có thể được nghiền nát và trộn với nước để uống.
Viên Xabantk nghiền nát cũng có thể được cho qua ống thông dạ dày sau khi xác nhận vị trí đặt dạ dày chính xác của ống. Viên nén nghiền nát nên được cho vào một lượng nước nhỏ qua ống thông dạ dày sau đó nên rửa sạch bằng nước.
Tham khảo thêm thuốc đột quỵ khác tại Nhà thuốc Bạch Mai:
|
Sản phẩm |
Công dụng |
Ưu điểm | Nhược điểm | Hình ảnh sản phẩm |
|
Giá: 868.840 đ/hộp |
Xarelto 15mg dùng để dự phòng huyết khối tắc tĩnh mạch. | Sản phẩm giá hợp lý, hàng sản xuất tại Đức theo tiêu chuẩn châu Âu. |
Sản phẩm chỉ dùng cho người lớn từ 18 tuổi trở lên. |
 |
|
Giá: 890.008 đ/hộp |
Xarelto 20mg dự phòng đột quỵ và thuyên tắc tĩnh mạch. | Giá sản phẩm hợp lý, hàng sản xuất tại Đức theo tiêu chuẩn châu Âu. | Sản phẩm dùng cho người lớn từ 18 tuổi trở lên. |
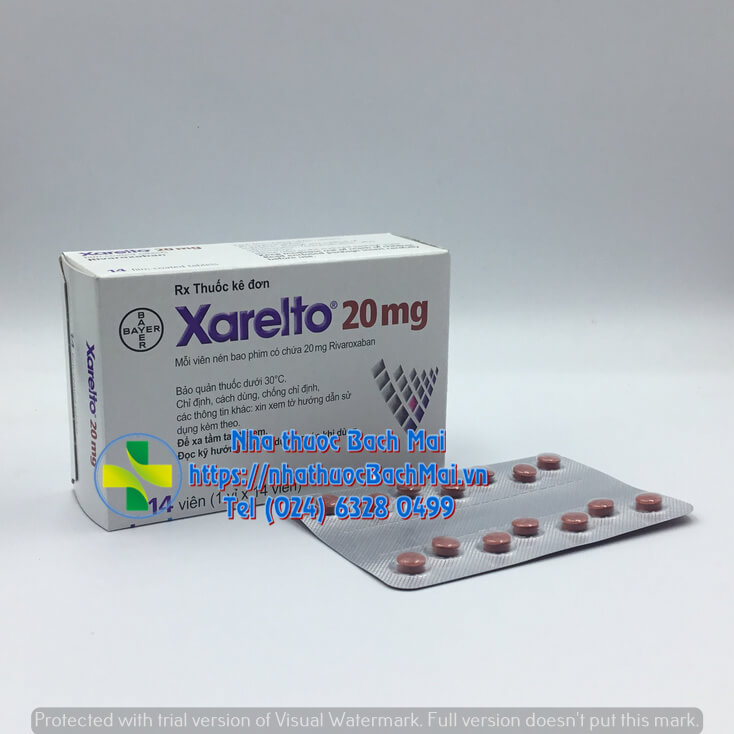 |
Mua Xabantk 15mg ở đâu, giá bao nhiêu?Xabantk 15mg được bán tại các quầy thuốc, nhà thuốc trên toàn quốc. Nhà thuốc Bạch Mai có dịch vụ hỗ trợ mua thuốc theo đơn và giao thuốc tại nhà. Đăng ký GỬI ĐƠN THUỐC VÀ NHẬN THUỐC TẠI NHÀ, Tại đây. Giá Xabantk 15mg tham khảo tại Nhà thuốc Bạch Mai là 320.000 đ/ hộp.
|
||||
Chống chỉ định Xabantk ở bệnh nhân mẫn cảm với rivaroxaban hoặc bất kỳ thành phần nào của thuốc.
– Chống chỉ định Xabantk ở bệnh nhân đang chảy máu đáng kể liên quan lâm sàng (như chảy máu nội sọ, xuất huyết tiêu hóa).
– Chống chỉ định Xabantk ở các bệnh nhân mắc bệnh gan đi kèm với rối loạn đông máu và nguy cơ chảy máu có liên quan về mặt lâm sàng kể cả những bệnh nhân xơ gan với xếp loại Child Pugh B và C.
– Xabantk chống chỉ định ở các bệnh nhân có tổn thương hoặc có bệnh lý, nếu được xem là một nguy cơ chảy máu nghiêm trọng. Điều này có thể bao gồm loét đường tiêu hóa hiện tại hoặc gần đây, xuất hiện khối u ác tính với nguy cơ chảy máu cao, gần đây có tổn thương nào hoặc cột sống, gần đây có phẫu thuật não, cột sống hoặc mắt, xuất huyết nội sọ gần đây, được biết hoặc nghi ngờ giãn tĩnh mạch thực quản, dị dạng động tĩnh mạch, phình mạch máu hoặc các bất thường mạch máu lớn trong cột sống hoặc nội sọ.
– Xabantk chống chỉ định ở các bệnh nhân dùng phối hợp với các thuốc chống động như heparins không phân đoạn (UFH), heparin trọng lượng phân tử thấp (enoxaparin, dalteparin, W…), các dẫn xuất heparin (fondaparinux, W…), thuốc chống đồng dạng uống warfarin, dabigatran etexalate, apixaban, W …), trừ các trường hợp đặc biệt trong liệu trình chuyển đổi thuốc kháng đông (xem mục “Liều lượng và Cách dùng”) hoặc khi UFH được sử dụng ở liều cần thiết để duy trì catheter động hoặc tĩnh mạch trung tâm mở.
– Độ an toàn và hiệu quả của Xabantk trên phụ nữ có thai chưa được thiết lập. Các dữ liệu trên động vật cho thấy rivaroxaban qua được hàng rào nhau. thai. Do đó, chống chỉ định Xabantk trong suốt thời gian mang thai (xem phần “Sử dụng ở phụ nữ có thai và cho con bú”).
– Độ an toàn và hiệu quả của Xabantk trên phụ nữ cho con bú chưa được thiết lập. Các dữ liệu trên động vật cho thấy rivaroxaban có bài tiết vào sữa mẹ.
Do đó, người mẹ chỉ sử dụng Xabantk khi ngừng cho con bú (xem phần “Sử dụng ở phụ nữ có thai và cho con bú).
Nguy cơ xuất huyết
Cũng như với các thuốc chống động khác, những bệnh nhân sử dụng Xabantk phải được quan sát cẩn thận đối với các dấu hiệu chảy máu. Khuyến cáo nên sử dụng thận trọng trong những chứng bệnh có gia tăng nguy cơ xuất huyết. Phải ngưng dùng Xabantk nếu có xuất huyết xảy ra. Trong những nghiên cứu lâm sàng, những cháy máu niêm mạc (như chảy máu cam, lợi, tiêu hóa, niệu sinh dục) và thiếu máu thường được thấy nhiều hơn trong thời gian điều trị rivaroxaban lâu dài so với điều trị VKA. Vì vậy, ngoài theo dõi lâm sàng đầy đủ, thì các test xét nghiệm hemoglobin / hematocrit có thể có giá trị phát hiện chảy máu bị che lấp, khi được đánh giá thích đáng. Vài phân nhóm bệnh nhân, như được trình bày chi tiết dưới đây, có nguy cơ chảy máu gia tăng. Những bệnh nhân này phải được theo dõi các dấu hiệu và triệu chứng của các biến chứng chảy máu và thiếu máu một cách cẩn thận sau khi bắt đầu điều trị (xem phần ‘Những tác dụng không mong muốn).
Bất kỳ sự tụt giảm hemoglobin hay huyết áp không giải thích được phải tìm kiếm vị trí chảy máu. Mặc dù điều trị với rivaroxaban không cần phải theo dõi thường quy sự phơi nhiễm thuốc, nhưng nồng độ rivaroxaban được đo lường với xét nghiệm định lượng kháng Yếu Tố Xa được chuẩn định có thể có ích lợi trong những trường hợp ngoại lệ mà sự am hiểu về phơi nhiễm rivaroxaban có thể giúp cho những quyết định về lâm sàng, v.d, quá liều và phẫu thuật cấp cứu (xem phần “Đặc điểm dược lực học và Dược động học “)
Các yếu tố xuất huyết khác
Tương tự như các thuốc chống huyết khối khác, cần thận trọng khi sử dụng Xabantk ở các bệnh nhân có nguy cơ cao chảy máu như:
– Rối loạn chảy máu bẩm sinh hoặc mắc phải
– Tăng huyết áp động mạch nghiêm trọng không kiểm soát được
– Bệnh loét đường tiêu hóa đang tiến triển
– Loét đường tiêu hóa gần đây
– Bệnh lý võng mạc do mạch máu
– Chảy máu nội sọ hoặc chảy máu não gần đây
– Bất thường mạch máu trong tủy sống hoặc trong não
– Phẫu thuật não, tủy sống hoặc nhãn khoa gần đây
– Giãn phế quản hoặc tiền sử chảy máu phối
Cần theo dõi bệnh nhân nếu bệnh nhân đang dùng đồng thời với các thuốc ảnh hưởng đến quá trình cầm máu – đông máu như các thuốc chống viêm không phải steroid (NSAID), thuốc ức chế kết tập tiểu cầu hoặc các thuốc chống huyết khối khác.
Xem xét điều trị dự phòng chảy máu trên bệnh nhân có nguy cơ loét đường tiêu hóa (xem phần “Tương tác với thuốc khác và các dạng tương tác khác ). Phải tìm vị trí xuất huyết khi hemoglobin hoặc huyết áp giảm không giải thích được
Phẫu thuật và can thiệp
Khi cần tiến hành các thủ thuật xâm lấn hoặc can thiệp phẫu thuật, nên ngừng điều trị bằng Xabantk tối thiểu 24 giờ trước khi thực hiện can thiệp nếu có thể và dựa trên sự đánh giá làm sàng của bác sĩ.
Nếu không thể trì hoãn việc thực hiện thủ thuật, thì nên đánh giá sự tăng nguy cơ chảy máu với tính cấp thiết của can thiệp.
Sau khi tiến hành các thủ thuật xâm lấn hoặc can thiệp phẫu thuật, nên bắt đầu sử dụng lại Xabantk ngay khi có thể miễn là tình trạng lâm sàng cho phép và quá trình cầm máu đầy đủ đã được thiết lập.
Gây tê trục thần kinh (ngoài màng cứng tủy sống)
Khi gây tê trục thần kinh (ngoài màng cứng/ tủy sống) hoặc chọc dò tủy sống, bệnh nhân được điều trị bằng thuốc chống huyết khối để ngăn chặn biến chứng huyết khối có nguy cơ bị tụ máu tủy sống hoặc ngoài màng cứng có thể dẫn đến liệt lâu dài.
Nguy cơ này thậm chí còn tăng cao khi sử dụng thủ thuật đặt ống thông ngoài màng cứng hoặc sử dụng đồng thời thuốc cầm máu. Nguy cơ cũng có thể tăng lên do chấn thương hoặc tái chọc dò tùy sống hoặc ngoài màng cứng.
Bệnh nhân nên được thường xuyên theo dõi dấu hiệu và triệu chứng suy thần kinh (ví dụ, tê chân hoặc chân yếu, sự bất thường của ruột hoặc bàng quang). Trong trường hợp ghi nhận sự suy yếu thần kinh, cần chẩn đoán và điều trị khẩn cấp.
Bác sỹ nên cân nhắc nguy cơ và lợi ích tiềm tàng trước khi can thiệp trục thần kinh ở bệnh nhân đã hoặc sắp dùng kháng đồng để dự phòng huyết khối. Không nên rút ống thông ngoài màng cứng sớm hơn 18 giờ sau lần uống Xabantk cuối.
Nên uống Xabantk sớm nhất là 6 giờ sau khi rút bỏ ống thông.
Nếu có sang thương do chọc dò, Xabantk nên được uống chậm lại 24 giờ.
Bệnh nhân thay van tim nhân tạo
Độ an toàn và hiệu quả của Xabantk chưa được nghiên cứu ở bệnh nhân thay van tim nhân tạo; do đó, không có dữ liệu cho thấy Xabantk đem lại sự chống đồng đầy đủ ở những bệnh nhân này.
Điều trị DVT và PE: Những bệnh nhân bị thuyền tắc phổi (PE) có huyết động học không ổn định hoặc bệnh nhân cần làm tan huyết khối hay thủ thuật lấy bỏ vật nghẽn mạch phổi
Xabantk không khuyến cáo điều trị thay thế cho heparin không phân đoạn trên bệnh nhân có thuyên tắc phối có huyết động học không ổn định hoặc có thể điều trị tan huyết khối hay làm thủ thuật lấy bỏ vật nghẽn mạch phổi do độ an toàn và hiệu quả của Xabantk chưa được chứng minh trong những tình huống làm sàng này.
Thuốc dùng đồng thời
Không khuyến cáo sử dụng đồng thời Xabantk và thuốc chống nấm nhóm azol dùng đường toàn thân (như ketoconazol) hoặc các thuốc ức chế protease HIV (như ritonavir). Những thuốc này là các chất ức chế mạnh cả CYP 3A4 lần P-gp. Do đó, các thuốc này làm tăng nồng độ rivaroxaban trong huyết tương đến mức độ có liên quan đến lâm sàng (trung bình gấp 2,6 lần) có thể dẫn đến tăng nguy cơ chảy máu (xem phần Tương tác với thuốc khắc và các dạng tương tác khác). Tuy nhiên, thuốc chống năm nhóm azol như fluconazol là một chất ức chế CYP 3A4 ở mức độ trung bình, ít có ảnh hưởng lên sự phổi nhiễm của rivaroxaban hơn và có thể được dùng đồng thời (xem phần Tương tác với thuốc khác và các dạng tương tác khác).
– Điều trị DVT và PE: Suy giảm chức năng thận
Ở bệnh nhân suy giảm chức năng thận ở mức độ trung bình, nên thận trọng khi sử dụng Xabantk đồng thời với các thuốc khác làm tăng nồng độ rivaroxaban trong huyết tương (xem phần Tương tác với thuốc khác và các dạng tương tác khác).
– Điều trị SPAF, DVT và PE: Suy giảm chức năng thận
ở bệnh nhân suy giảm chức năng thận nặng, nồng độ rivaroxaban có thể tăng lên đáng kể (trung bình gấp 1,6 lần) có thể dẫn đến tăng nguy cơ chảy máu.
Do các dữ liệu lâm sàng còn hạn chế, nên thận trọng khi sử dụng Xabantk ở các bệnh nhân có Cr€ <30-15 mL/phút.
Không có các dữ liệu lâm sàng đối với bệnh nhân suy giảm chức năng thận nặng. Do đó, không khuyến cáo sử dụng Xabantk ở các bệnh nhân này (xem phần “Liều dùng và cách dùng). Cần theo dõi chặt chẽ các dấu hiệu của biến chứng chảy máu sau khi bắt đầu điều trị ở bệnh nhân suy giảm chức năng thận nặng hoặc tăng nguy cơ chảy máu và bệnh nhân sử dụng đồng thời thuốc chống nấm nhóm azole dùng đường toàn thân hoặc các thuốc ức chế protease HIV (xem phần Tương tác với thuốc khác và các dạng tương tác khác).
Phụ nữ ở độ tuổi sinh sản
Chỉ nên sử dụng Xabantk ở phụ nữ ở độ tuổi sinh sản khi có biện pháp tránh thai hiệu quả.
Kéo dài khoảng QTc
Xabantk không có tác dụng kéo dài khoảng QTc.
Tóm tắt hồ sơ an toàn
Sự an toàn của Rivaroxaban đã được đánh giá trong mười ba nghiên cứu pha III bao gồm 53. 103 bệnh nhân tiếp xúc với Rivaroxaban (xem Bảng 1). Bảng 1: Số bệnh nhân được nghiên cứu, tổng liều hàng ngày và thời gian điều trị tối đa trong các nghiên cứu pha III
| Chỉ định | Số bệnh nhân* | Tổng liều hàng ngày | Thời gian điều trị tối đa |
| Phòng ngừa huyết khối tĩnh mạch (VTE) ở bệnh nhân trưởng thành trải qua phẫu thuật thay khớp háng hoặc khớp gối tự chọn | 6097 | 10 mg | 39 ngày |
| Phòng ngừa VTE ở bệnh nhân mắc bệnh nội khoa | 3997 | 10 mg | 39 ngày |
| Điều trị DVT, PE và phòng ngừa tái phát | 6790 |
Ngày 1 – 21 : 30 mg Ngày 22 trở đi: 20 mg
|
21 tháng |
| Phòng ngừa đột quỵ và thuyên tắc hệ thống ở bệnh nhân rung nhĩ không do van tim | 7750 | 20 mg | 41 tháng |
| Ngăn ngừa các biến cố xơ vữa động mạch ở bệnh nhân sau một hội chứng mạch vành cấp tỉnh (ACS) | 10225 | 5 mg hoặc 10 mg tương ứng, dùng đồng thời với ASA hoặc ASA cộng với clopidogrel hoặc ticlopidine | 31 tháng |
| Ngăn ngừa biến cố xơ vữa động mạch ở bệnh nhân CAD / PAD | 18244 | 5 mg phối hợp với ASA hoặc 10 mg một mình | 47 tháng |
| *Bệnh nhân tiếp xúc với ít nhất một liều Rivaroxaban |
|||
Các phản ứng bất lợi thường được báo cáo nhất ở những bệnh nhân sử dụng Rivaroxaban là chảy máu. Chảy máu thường được báo cáo là epistaxis (4,596) và xuất huyết đường tiêu hóa (3,8%).
Bảng 2: Chảy máu ” và tỷ lệ biến cố thiếu máu ở những bệnh nhân tiếp xúc với Rivaroxaban trong các nghiên cứu pha III đã hoàn thành
| Chỉ định | Bất kỳ chảy máu | Thiếu máu |
| Phòng ngừa huyết khối tĩnh mạch (VTE) ở bệnh nhân trưởng thành trải qua phẫu thuật thay khớp háng hoặc khớp gối tự chọn | 6,8% bệnh nhân | 5,9% bệnh nhân |
| Dự phòng huyết khối tĩnh mạch ở bệnh nhân mắc bệnh nội khoa | 12,6% bệnh nhân | 2,1% bệnh nhân |
| Điều trị DVT, PE và phòng ngừa tái phát | 23% bệnh nhân | 1,6% bệnh nhân |
| Phòng ngừa đột quỵ và thuyên tắc hệ thống ở bệnh nhân rung nhĩ không do van tim | 28 trên 100 năm bệnh nhân | 2,5 trên 100 năm bệnh nhân |
| Ngăn ngừa biến cố xơ vữa động mạch ở bệnh nhân sau ACS | 22 trên 100 năm bệnh nhân | 1,4 trên 100 năm bệnh nhân |
| Ngăn ngừa biến có xơ vữa động mạch ở bệnh nhân CAD / PAD | 6,7 trên 100 năm bệnh nhân | 0,15 trên 100 năm bệnh nhân |
|
* Đối với tất cả các nghiên cứu về Rivaroxaban, tất cả các sự kiện chảy máu được thu thập, báo cáo và xét xử. **Trong nghiên cứu của COMPASS, tỷ lệ thiếu máu thấp do cách tiếp cận có chọn lọc đối với tập hợp sự kiện bất lợi đã được áp dụng |
||
Bảng liệt kê các phản ứng bất lợi
Tấn số của các phản ứng bất lợi được báo cáo với Xabantk được tóm tắt trong Bảng 3 dưới đây theo lớp cơ quan hệ thống (trong MedDRA) và theo tần số. Tần số được định nghĩa là: rất phổ biến (≥ 1/10), phổ biến (100 1/100 đến <1/10); không phổ biến (≥ 1/1.000 đến <1/100); hiếm (≥ 1/10.000 đến <1/1.000); rất hiếm (<1/10.000); không biết (không thể ước tính từ dữ liệu có sẵn).
Bảng 3: Tất cả các phản ứng bất lợi được báo cáo ở bệnh nhân trong các thử nghiệm lâm sàng giai đoạn III hoặc thông qua sử dụng*
| Chung | Không phổ biến | Hiếm | Rất hiếm | Chưa xác định |
| Rối loạn hệ thống máu và bạch huyết | ||||
| Thiếu máu (bao gồm các thông số trong phòng thí nghiệm tương ứng) | Tăng tiểu cầu (bao gồm số lượng tiểu cầu tăng)*, Giảm tiểu cầu | |||
| Rối loạn hệ thống miễn dịch | ||||
| Phản ứng dị ứng, dị ứng viêm da, phù mạch và phù dị ứng | Phản ứng phản vệ bao gồm sốc phản vệ | |||
| Rối loạn hệ thần kinh | ||||
| Chóng mặt, nhức đầu | Xuất huyết não và nội sọ, ngất | |||
| Rối loạn mắt | ||||
| Xuất huyết mắt (bao gồm xuất huyết kết mạc) | ||||
| Rối loạn tim | ||||
| Nhịp tim nhanh | ||||
| Rối loạn mạch máu | ||||
| Hạ huyết áp, tụ máu | ||||
| Rối loạn hô hấp, lồng ngực và trung thất | ||||
| Epistaxis, xuất huyết | ||||
| Rối loạn tiêu hóa | ||||
| Chảy máu nướu, xuất huyết đường tiêu hóa (bao gồm xuất huyết trực tràng), đau dạ dày và tiêu hóa, khó tiêu, buồn nôn, táo bón “, tiêu chảy, nôn mửa | Khô miệng | |||
| Rối loạn gan mật | ||||
| Tăng transaminase | Suy gan, tăng bilirubin, tăng phosphatase kiêm máu, tăng GGT | Vàng da, Bilirubin liên hợp tăng (có hoặc không kèm theo tăng ALT), Cholestosis; Viêm gan (bao gồm tổn thương tế bào gan) | ||
| Rối loạn da và mô dưới da | ||||
| Ngứa (bao gồm các trường hợp hiếm gặp của ngứa toàn thân), phát ban, ecchymosis, xuất huyết dưới da và dưới da | Mề đay | Hội chứng Stevens-J ohnson / Hoại tử biểu mô nhiễm độc, hội chứng DRESS | ||
| Rối loạn cơ xương và mô liên kết | ||||
| Đau ở tứ chi | Haemarthrosis | Xuất huyết cơ bắp | Hội chứng khoang thứ phát do chảy máu | |
| Rối loạn thận và tiết niệu | ||||
| Xuất huyết đường tiết niệu (bao gồm tiểu máu và rong kinh”), suy thận (bao gồm creatinine máu tăng, urê máu tăng) | Suy thân / suy thận cấp thứ phát do chảy máu đủ để gây ra giảm tưới máu | |||
| Rối loạn chung và điều kiện trang web quản trị | ||||
| Sốt *, phù ngoại biên, giảm sức mạnh và năng lượng chung (bao gồm mệt mỏi và suy nhược) | Cảm thấy không khỏe | (bao gồm khó chịu) | Phủ cục bộ | ||
| Điều tra | ||||
| Tăng LDH, täng lipase”, tăng amylase | ||||
| Chấn thương, ngộ độc và các biến chứng về thủ tục | ||||
| Xuất huyết sau phẫu thuật (bao gồm thiếu máu sau phẫu thuật và xuất huyết vết thương), nhiễm trùng, bài tiết vết thương | Pseudoaneurysm mạch máu | |||
A: quan sát trong phòng ngừa VTE ở bệnh nhân trưởng thành trải qua phẫu thuật thay khớp háng hoặc khớp gối tự chọn
B: quan sát trong điều trị DVT, PE và phòng ngừa tái phát là rất phổ biến ở phụ nữ <55 tuổi
C: quan sát là không phổ biến trong phòng ngừa biến cố xơ vữa động mạch ở bệnh nhân sau khi điều trị ACS (sau can thiệp mạch vành qua da)
* Một cách tiếp cận chọn lọc được chỉ định trước cho bộ sưu tập sự kiện bất lợi đã được áp dụng. Vì tỷ lệ phản ứng bất lợi không tăng và không có phản ứng bất lợi mới được xác định, dữ liệu nghiên cứu của COMPASS không được đưa vào để tính tần số trong bảng này.
Mô tả các phản ứng bất lợi được lựa chọn
Việc sử dụng Xabantk có thể liên quan đến việc tăng nguy cơ chảy máu hoặc chảy máu từ bất kỳ mô hoặc cơ quan nào có thể dẫn đến thiếu máu sau xuất huyết. Các dấu hiệu, triệu chứng và mức độ nghiêm trọng (bao gồm cả kết quả gây tử vong) sẽ khác nhau tùy theo vị trí và mức độ hoặc mức độ chảy máu và / hoặc thiếu máu. Trong các nghiên cứu lâm sàng chảy máu niêm mạc (ví dụ như chảy máu cam, nướu, đường tiêu hóa, tiết niệu bao gồm chảy máu âm đạo bất thường hoặc tăng kinh nguyệt) và thiếu máu thường gặp hơn khi điều trị bằng Rivaroxaban dài hạn so với điều trị VKA. Do đó, ngoài việc giám sát làm sàng đầy đủ, xét nghiệm hemoglobin / hematocrit trong phòng thí nghiệm có thể có giá trị để phát hiện chảy máu huyền bí và định lượng mức độ phù hợp lâm sàng của chảy máu quá mức, như được đánh giá là phù hợp. Nguy cơ chảy máu có thể tăng lên ở một số nhóm bệnh nhân, ví dụ như những bệnh nhân bị tăng huyết áp nặng không kiểm soát được và / hoặc điều trị đồng thời ảnh hưởng đến việc cầm máu. Chảy máu kinh nguyệt có thể được tăng cường và / hoặc kéo dài. Các biến chứng xuất huyết có thể là yếu, xanh xao, chóng mặt, nhức đầu hoặc sưng không rõ nguyên nhân, khó thở và sốc không rõ nguyên nhân. Trong một số trường hợp do hậu quả của thiếu máu, các triệu chứng thiếu máu cơ tim như đau ngực hoặc đau thắt ngực đã được quan sát. Chảy máu kinh nguyệt có thể được tăng cường và / hoặc kéo dài. Các biến chứng xuất huyết có thể là yếu, xanh xao, chóng mặt, nhức đầu hoặc sưng không rõ nguyên nhân, khó thở và sốc không rõ nguyên nhân. Trong một số trường hợp do hậu quả của thiếu máu, các triệu chứng thiếu máu cơ tim như đau ngực hoặc đau thắt ngực đã được quan sát. Chảy máu kinh nguyệt có thể được tăng cường và / hoặc kéo dài. Các biến chứng xuất huyết có thể là yếu, xanh xao, chóng mặt, nhức đầu hoặc sưng không rõ nguyên nhân, khó thở và sốc không rõ nguyên nhân. Trong một số trường hợp do hậu quả của thiếu máu, các triệu chứng thiếu máu cơ tim như đau ngực hoặc đau thắt ngực đã được quan sát.
Các biến chứng được biết đến thứ phát sau chảy máu nghiêm trọng như hội chứng khoang và suy thận do giảm tưới máu đã được báo cáo cho Xabantk. Do đó, khả năng xuất huyết sẽ được xem xét trong việc đánh giá tình trạng ở bất kỳ bệnh nhân chống đông máu nào.
Tóm lược dữ liệu về độ an toàn: Tính an toàn của Xabantk đã được đánh giá trong bốn nghiên cứu pha III bao gồm 6097 bệnh nhân dùng Xabantk 10mg phẫu thuật chỉnh hình chi dưới (thay toàn bộ khớp háng hay khớp gối) trên 3997 bệnh nhân bệnh nội khoa nhập viện được điều trị tới 39 ngày, và trong ba thử nghiệm pha III điều tri VTE với 4556 bệnh nhân dùng hoặc 15mg Xabantk 2 lần mỗi ngày trong 3 tuần tiếp theo 20mg một lần/ngày hoặc 20mg một lần mỗi ngày điều trị đến 21 tháng. Hơn nữa tính an toàn của Xabantk cũng đã được đánh giá trên 7750 bệnh nhân bị rung nhĩ không do van tim từ hai nghiên cứu pha III với ít nhất một liều Xabantk cũng như trên 10225 bệnh nhân ACS với ít nhất một liều hoặc 2,5mg (hai lần/ngày) hoặc 5mg (hai lần mỗi ngày) Xabantk thêm vào hoặc ASA hoặc ASA cùng với dopidogrel hay ticlopidine.
Trên các bệnh nhân được điều trị để dự phòng tử vong do tim mạch và nhồi máu cơ tim sau một biến có hội chứng vành cấp (ACS), chảy máu bất kỳ dạng nào hoặc nặng được báo cáo với tỷ lệ biến cố là 22/100 bệnh nhân năm. Thiếu máu được báo cáo với tỷ lệ biến cố là 1,4/100 bệnh nhân năm.
Do phương thức tác dụng dược lý học, Xabantk có thể đi kèm với tăng nguy cơ chảy máu sâu hoặc nóng từ bất kỳ mô hoặc cơ quan nào trong cơ thể, có
thể dẫn đến thiếu máu sau xuất huyết. Nguy cơ chảy máu tăng lên ở một số nhóm bệnh nhân, như bệnh nhân tăng huyết áp động mạch nghiêm trọng không kiểm soát được và/hoặc dùng đồng thời các thuốc ảnh hưởng đến quá trình cầm máu (xem phần “Cảnh báo”).
Các dấu hiệu, triệu chứng và mức độ nặng (bao gồm cả tử vong) thay đổi tùy theo vị trí và mức độ hoặc phạm vi chảy máu và/hoặc thiếu máu (xem phần “Quá liều/ Xử trí thiếu máu”).
Biến chứng xuất huyết thường được biểu hiện như yếu cơ, tái nhợt, choáng váng, đau đầu hoặc sưng không giải thích được, khó thở và sốc không giải thích được. Trong một vài trường hợp, ghi nhận được các triệu chứng thiếu máu cục bộ tim như đau ngực hoặc cơn đau thắt ngực, có thể là hậu quả của thiếu máu.
Các biến chứng từ thứ yếu đến chảy máu nghiêm trọng như hội chứng chèn ép khoang và suy thận do giảm tưới máu cũng đã được báo cáo cho Xabantk.
Do đó, cần cân nhắc khả năng xuất huyết trong việc đánh giá tình trạng bệnh ở bất kỳ các bệnh nhân được điều trị chống đông.
Các khảo sát sau khi thuốc đưa ra thị trường. Các phản ứng ngoại ý dưới đây được ghi nhận cùng với thời gian Xabantk lưu hành trên thị trường.
+ Các rối loạn hệ thống miễn dịch; phù mạch và phủ dị ứng.
+ Các rối loạn đường mặt của gan: tắc mật, viêm gan (bao gồm tổn thương tế bào gan).
+ Các rối loạn hệ thống máu và bạch huyết giảm tiểu cầu.
Tương tác dược động học:
Rivaroxaban thải trừ chủ yếu qua chuyển hóa ở gan nhờ trung gian cytocrome P450 (CYP 3A4, CYP 2J2) và bài tiết qua thận dưới dạng không đối, liên quan đến hệ thống vận chuyển P-glycoprotein (P-gp)/protein kháng ung thư vú (Bcrp).
+ Ức chế CYP: Rivaroxaban không ức chế CYP3A4 hoặc bất kỳ CYP đồng dạng (isoform) chủ yếu nào khác.
+ Cảm ứng CYP: Rivaroxaban không cảm ứng CYP3A4 hoặc bất kỳ CẤP đồng dạng chủ yếu nào khác.
+ Ảnh hưởng lên rivaroxaban: Việc sử dụng đồng thời Xabantk với các chất ức chế CYP3A4 và P-gp mạnh, có thể dẫn đến sự giảm độ thanh thải qua cả gan lẫn thận và do đó, làm tăng đáng kể sự phơi nhiễm của thuốc trong cơ thể. Dùng đồng thời Xabantk và thuốc chống nấm nhóm azole như ketoconazole (400mg ngày 1 lần) – một chất ức chế CYP3A4 và P-gp mạnh, dẫn đến AUC trung bình của rivaroxaban ở trạng thái ổn định tăng gấp 2,6 lần và Cmax trung bình rivaroxaban tăng gấp 1,7 lần cùng với sự tăng đáng kể tác dụng dược lực học của thuốc. Dùng đồng thời Xabantk và thuốc ức chế protease HIV như ritonavir (600mg ngày 2 lần) – một chất ức chế CYP3A4 và P-gp mạnh, dẫn đến AUC trung bình của rivaroxaban ở trạng thái ổn định tăng gấp 2,5 lần và Cmax trung bình của maroxaban tăng gấp 1,6 lần cùng với sự tăng đáng kể tác dụng được lực học của thuốc. Vì vậy, không khuyến cáo sử dụng Xabantk đồng thời với các thuốc kháng nấm nhóm azole dùng đường toàn thân như ketoconazole, itraconazole, voriconazole và posaconazole hoặc các thuốc ức chế protease HIV (xem phần “Cảnh báo”). Người ta cho rằng các chất có hoạt tính khác chỉ ức chế một trong các đường thải trừ rivaroxaban, hoặc là CYP3A4 hoặc là P-gp, sẽ làm tăng nồng độ rivaroxaban trong huyết tương đến một mức độ ít hơn.
Clarithromycin (500mg ngày 2 lần), được xem là một chất ức chế CYP3A4 mạnh và ức chế P-gp trung bình, khi sử dụng đồng thời dẫn đến AUC trung bình của rivaroxaban tăng gấp 1,5 lần và Cmax tăng gấp 1,4 lần. Sự tăng lên gần với tầm biến thiên bình thường của AUC và Cmax được coi là không liên quan về mặt lâm sàng.
Erythromycin (500mg 3 lần/ngày), ức chế CYP3A4 và P-gp ở mức vừa phải, khi sử dụng đồng thời, dẫn đến AUC và Cmax trung bình của rivaroxaban tăng gấp 1,3 lần. Sự tăng lên này nằm trong tầm biến thiên bình thường của AUC và Cmax và được coi là không liên quan về lâm sàng. Trên những đối tượng bệnh nhân suy thận mức độ nhẹ, erythromycin (500mg 3 lần/ngày) làm tăng 1,8 lần giá trị trung bình AUC của rivaroxaban và 1,6 lần (max khi so sánh với đối tượng bệnh nhân chức năng thận bình thường không sử dụng thuốc đồng thời. Trên những đối tượng bệnh nhân suy thận mức độ trung bình, erythromycin làm tăng 2 lần giá trị trung bình AUC và 1,6 lần Cmax khi so sánh với đối tượng bệnh nhân chức năng thận bình thường không sử dụng thuốc đồng thời (xem mục “Cảnh báo”).
Fluconazole (400mg một lần/ngày), được xem là thuốc ức chế CYP3A4 vừa phải, dẫn đến tăng AUC trung bình của rivaroxaban lên 1,4 lần và tăng Cmax trung bình lên 1,3 lần. Sự tăng này vẫn trong giới hạn biến thiên bình thường của AUC và Cmax và được xem là không liên quan về mặt lâm sàng (xem phần “Cảnh báo”).
Dùng đồng thời Xabantk với chất cảm ứng CYP3A4 và P-gp mạnh như rifampicin dẫn đến AUC trung bình của rivaroxaban giảm khoảng 50% song song với giảm tác dụng được lực học của thuốc (xem phần “Dược động học”).
Dùng đồng thời Xabantk với các chất cảm ứng CYP3A4 mạnh khác (như phenytoin, carbamazepine, phenobarbitone hoặc St. John’s Wort) có thể cũng dẫn đến giảm nồng độ rivaroxaban trong huyết tương. Nên thận trọng khi sử dụng đồng thời với các chất cảm ứng CYP3A4 mạnh. Sự giảm nồng độ rivaroxaban trong huyết tương được coi là không có thích đáng về mặt lâm sàng đối với những bệnh nhân điều trị bằng Xabantk 1 lần/ngày để phòng ngừa thuyên tắc huyết khối tĩnh mạch (VTE) sau phẫu thuật theo chương trình chỉnh hình khớp háng và khớp gối. Tương tác dược lực học
+ Các thuốc chống đông: Sau khi sử dụng phối hợp enoxaparin (40mg đơn liều) và Xabantk (10mg đơn liều), ghi nhận có tác dụng cộng thêm trên hoạt tính ức chế yếu tố Xa nhưng không có bất kỳ tác động cộng thêm test đông máu (PT, aPTT). Enoxaparin không tác động đến dược động học của rivaroxaban (xem phần “Cảnh báo”). Do nguy cơ chảy máu gia tăng, nên cần chú ý bệnh nhân nếu điều trị đồng thời với bất kỳ các thuốc chống đông khác (xem phần “Cảnh báo”).
+ NSAIDs/Các thuốc ức chế kết tập tiểu cầu. Clopidogrel (liều nạp 300mg, sau đó dùng liều duy trì 75mg) không thấy có tương tác được động học (với Xabantk 15mg) nhưng ở một nhóm nhỏ bệnh nhân ghi nhận được sự tăng liên quan đến thời gian chảy máu, mà không có tương quan đến sự kết tập tiểu cầu, P-selectin hoặc nồng độ của thụ thể GPlib/ Illa (xem phần “Cảnh báo”). Sau khi sử dụng đồng thời Xabantk (15mg) và naproxen 500mg, không thấy có sự kéo dài liên quan đến thời gian chảy máu về mặt lâm sàng. Tuy nhiên, đáp ứng được lực học trên một số bệnh nhân có thể rõ rệt hơn (xem phần “Cảnh báo”). Chưa thấy có các tương tác được động học và dược lực học đáng kể về mặt lâm sàng khi rivaroxaban được dùng đồng thời với 500mg acetylsalicylic acid. Cần chú ý bệnh nhân nếu điều trị bệnh nhân đồng thời với NSAIDs (bao gồm acetylsalicylic acid) và các thuốc ức chế kết tập tiểu cầu vì các thuốc này làm tăng nguy cơ chảy máu một cách đặc trưng (xem phần Cảnh báo ).
+ Warfarin: Việc chuyển đổi cho bệnh nhân từ warfarin (INR 2,0 – 3,0) sang Xabantk (20mg) hoặc từ Xabantk (20mg) sang warfarin (INR 2,0 – 3,0) làm thời gian prothrombin/INR (Neoplastin) tăng thêm nhiều hơn mức cộng hợp (có thể quan sát giá trị INR tăng lên đến 12), trong khi tác dụng lên trên aPTT, hoạt tính ức chế yếu tố Xa và thrombin nội sinh có khả năng cộng hợp. Nếu muốn kiểm tra tác dụng dược lực học của Xabantk trong giai đoạn chuyển đổi thuốc, có thể sử dụng các test về hoạt tính ức chế yếu tố Xa, PiCT và HepTest do những xét nghiệm này không bị tác động bởi warfarin. Từ ngày thứ 4 sau khi dừng warfarin trở đi, tất cả các test (bao gồm PT, aPTT, ức chế hoạt tính yếu tố Xa và ETP) chỉ phản ánh tác dụng của Xabantk (xem phần “Liều lượng và Cách dùng”). Nếu muốn kiểm tra tác dụng được lực học của Xabantk trong giai đoạn chuyển đổi thuốc, có thể đo lường chỉ số INR ở thời điểm rivaroxaban đạt nồng độ đáy (24 giờ sau khi uống liều rivaroxaban trước) do ở thời điểm đó, rivaroxaban ảnh hưởng đến xét nghiệm ở mức độ nhỏ nhất. Không ghi nhận tương tác được động học giữa warfarin và Xabantk.
Thức ăn và thực phẩm từ sữa: Xabantk có thể được dùng cùng hoặc không cùng với thức ăn (xem phần “Dược động học”). Viên nén Xabantk 15mg và Xabantk 20mg có thể uống cùng với thức ăn. Tương tác với các thông số xét nghiệm. Các thông số xét nghiệm đông máu (PT, aPTT, HepTest) được cho là có bị ảnh hưởng do phương thức tác dụng của Xabantk.
Phụ nữ có thai
Phụ nữ ở độ tuổi sinh sản/Tránh thai. Chỉ sử dụng Xabantk cho phụ nữ ở độ tuổi sinh sản có áp dụng các phương pháp tránh thai hiệu quả. Phụ nữ có thai Độ an toàn và hiệu quả của Xabantk ở phụ nữ có thai chưa được thiết lập. Trên chuột và thỏ, rivaroxaban thể hiện độc tính rõ rệt trên động vật mẹ với những sự thay đổi về nhau thai liên quan tới tác dụng dược lý học của thuốc (như biến chứng chảy máu), dẫn đến độc tính trên sinh sản. Không nhận dạng được khả năng gây quái thai chủ yếu nào.
Do nguy cơ chảy máu nội sinh và bằng chứng là rivaroxaban qua được hàng rào nhau thai, chống chỉ định Xabantk ở phụ nữ có thai (xem phần “Chống chỉ định” và “An toàn tiền lâm sàng”).
Phụ nữ cho con bú
Độ an toàn và hiệu quả của Xabantk ở phụ nữ cho con bú chứa được thiết lập. Ở chuột, rivaroxaban được bài tiết vào sữa mẹ. Do đó, Xabantk chống chỉ định trong thời gian nuôi con bằng sữa mẹ (xem phần “Chống chỉ định”). Cần phải quyết định ngưng cho bú hoặc ngừng thuốc điều trị.
Đã có báo cáo về các trường hợp ngất và choáng váng và có thể ảnh hưởng lên khả năng lái xe và vận hành máy móc (xem phần “Tác dụng không mong muốn”). Bệnh nhân gặp phải các phản ứng có hại này không nên lái xe hoặc sử dụng máy móc.
Các trường hợp quá liều hiểm lên đến 600mg được báo cáo, không có các biến chứng chảy máu hoặc các phản ứng có hại khác. Do sự hấp thu bị giới hạn, nên tác dụng trấn không tăng thêm sự phơi nhiễm huyết tương trung bình được mong đợi ở mức liều trên liều điều trị từ 50mg trở lên. Hiện chưa có chất giải độc đặc hiệu đối kháng tác dụng dược lực học của mvaroxaban. Sử dụng than hoạt để giảm hấp thu trong trường hợp quá liều Xabantk được xem xét.
Do rivaroxaban gắn kết với protein trong huyết tương cao nên người ta cho rằng không thể thẩm tách được. Xử trí chảy máu: Trên bệnh nhân uống rivaroxaban nếu xảy ra biến chứng chảy máu, thì nên tạm ngừng liều điều trị tiếp theo hoặc ngừng hẳn điều trị nếu thích hợp. Rivaroxaban có thời gian bán thái khoảng 5 đến 13 giờ. Việc xử trí cho riêng từng cá nhân tùy theo mức độ nặng và vị trí xuất huyết. Có thể sử dụng các biện pháp điều trị triệu chứng nếu cần thiết, như sử dụng thiết bị ép cơ học (như với chảy máu cam nặng), sự cầm máu trong phẫu thuật với các quy trình kiểm soát chảy máu, truyền dịch và các biện pháp hỗ trợ huyết động, các sản phẩm máu (hồng cầu lắng hoặc huyết tương đồng lạnh tươi tùy thuộc vào tình trạng thiếu máu hoặc bệnh đông máu đi kèm) và tiểu cầu. Nếu không thể kiểm soát tình trạng chảy máu bằng các biện pháp trên, nên xem xét sử dụng thuốc đặc hiệu đảo chiều chất tiền đông máu như phức hợp prothrombin cô đặc (PCC), phức hợp prothrombin hoạt hóa có đặc (APCC) hoặc yếu tố Vila tái tổ hợp (r-FVlla).
Tuy nhiên, hiện giờ có rất ít kinh nghiệm lâm sàng về việc sử dụng những chế phẩm này trên những bệnh nhân dùng Xabantk (xem “Dược lực học”). Protamine sulfate và vitamin K không được cho là có ảnh hưởng lên hoạt tính chống đông của rivaroxaban. Kinh nghiệm còn hạn chế về việc sử dụng các thuốc chống sự phân hủy sợi fibrin (acid tranexamic, acid aminocaproic) trên các bệnh nhân dùng Xabantk. Không có lý do lợi ích về mặt khoa học cũng như không có kinh nghiệm sử dụng với các chất cầm máu toàn thân desmopressin và aprotinin ở các bệnh nhân dùng Xabantk.
Bảo quản: Nơi khô mát, nhiệt độ dưới 30%, tránh ánh sáng.
Hạn dùng của thuốc 36 tháng kể từ ngày sản xuất.
Nhà sản xuất CÔNG TY CP DƯỢC HÀ TĨNH
167 Hà Huy Tập, Tp. Hà Tĩn
Sự ức chế yếu tố Xa phụ thuộc liều dùng được ghi nhận trên người. Thời gian prothrombin (PT) bị ảnh hưởng bởi rivaroxaban theo cách phụ thuộc liều với mối tương quan gần với nồng độ thuốc trong huyết tương (giá trị bằng 0,98) nếu sử dụng Neoplastin. Các thuốc thử khác sẽ cho kết quả khác nhau. Kết quả của PT được biểu thị theo giây, bởi chỉ số INR (International Normalized Ratio) chỉ được định cỡ và có giá trị cho coumarin và không được sử dụng cho bất kỳ thuốc chống đông nào khác.
Trong một nghiên cứu dược lý lâm sàng về sự đảo ngược được lực học của rivaroxaban trên đối tượng người lớn khỏe mạnh (n=22), hiệu quả đơn liều (S0IU/kg) của 2 loại PCC khác nhau, PCC gồm 3 yếu tố đông máu (yếu tố II, IX và X) và PCC gồm 4 yếu tố (yếu tố II, VII, IX và X) được đánh giá. PCC 3 giảm giá trị Neoplastin PT trung bình khoảng 1 giây trong vòng 30 phút, so với sự giảm khoảng 3,5 giây quan sát được ở PCC 4. Ngược lại, PCC 3 có hiệu quả chung mạnh và nhanh hơn trên thay đổi đảo ngược ở nhóm thrombin nội sinh so với PCC 4 (xem mục “Quá liều”). Ở bệnh nhẫn sử dụng rivaroxaban để điều trị DVT và PE và dự phòng tái phát DVT và PE hoặc trải qua đại phẫu chỉnh hình, bách phân vị 5/95 của PT (Neoplastin) 2 – 4 giờ sau khi uống thuốc (nghĩa là ở thời điểm thuốc có tác dụng tối đa) lần lượt trong giới hạn từ 13 tới 25 giây cho liều 2,5mg ngày 2 lần và cho liều 10mg/ngày hoặc 17 giây đến 32 giây cho liều 15mg ngày 2 lần hoặc từ 15 giây đến 30 giây cho liều 20mg ngày 1 lần.
Ở bệnh nhân rung nhĩ không do bệnh lý van tim sử dụng rivaroxaban để dự phòng đột quỵ và thuyền tắc mạch toàn thân, bách phân vị 5/95 cho PT (Neoplastin) 1 – 4 giờ sau khi uống viên thuốc (nghĩa là ở thời điểm thuốc có tác dụng tối đa) lần lượt trong giới hạn từ 14 giây đến 40 giây cho liều 20mg ngày 1 lần hoặc từ 10 giây đến 50 giây ở bệnh nhân suy giảm chức năng thận ở mức độ trung bình được điều trị với 15mg ngày 1 lần.
Thời gian prothrombin được hoạt hỏa từng phần (aPTT) và HepTest cũng bị kéo dài phụ thuộc liều dùng; tuy nhiên, các xét nghiệm này không được khuyến cáo để đánh giá tác dụng được lực học của rivaroxaban. Rivaroxaban cũng ảnh hưởng đến hoạt tính kháng với yếu tố Xa; tuy nhiên, hiện chưa có chuẩn để đánh giá
Không cần theo đài các thông số đông máu trong thời gian điều trị bằng Xabantk.
Tuy nhiên, khi có chỉ định trên lâm sàng, đo hiệu quả của rivaroxaban có thể được tiến hành bằng thử nghiệm đo nồng độ kháng Xa
+ SPAF: Hiệu quả lâm sàng và độ an toàn
Các chương trình thử nghiệm lâm sàng được thiết kế để chứng minh hiệu quả của Xabantk trong dự phòng đột quỵ và thuyền tắc toàn thân ở bệnh nhân rung nhĩ (AF) không do bệnh lý van tim.
Trong nghiên cứu mù đôi then chốt ROCKET-AF, 14.264 bệnh nhân được sử dụng hoặc Xabantk 20mg dùng đường uống ngày 1 lần (15mg dùng đường uống ngày 1 lần ở bệnh nhân suy giảm chức năng thận ở mức độ trung bình (GC: < 50 – 30mL/phút) hoặc warfarin chuẩn độ tới mục tiêu INR 2,5 (khoảng điều trị 2,0 – 3,0). Thời gian điều trị trung bình là 19 tháng và tổng toàn bộ thời gian điều trị là 41 tháng,
34,9% bệnh nhân đang điều trị bằng ASA và 11,4% dùng thuốc chống loạn nhịp tim nhóm III bao gồm amiodaron
Tương tự như warfarin, Xabantk làm giảm đáng kể kết cục chính hỗn hợp đột quỵ và thuyền tắc toàn thân ngoài hệ thần kinh trung ương. Ngoài ra, các kết cục phụ thứ yếu (hỗn hợp đột quỵ, thuyên tắc toàn thân ngoài hệ thần kinh trung ương và tử vong do bệnh mạch máu và hỗn hợp đột quỵ, thuyền tắc toàn thân ngoài hệ thần kinh trung ương, nhồi máu cơ tim và tử vong do bệnh mạch máu) cũng giảm rõ rệt (xem Bảng 2). Tỷ lệ xuất hiện đối với kết quả chính về an toàn (biến có chảy máu liên quan lâm sàng nặng hoặc không nặng) tương tự nhau ở cả hai nhóm điều trị (xem Bảng 3).
| Bảng 2: Kết quả về hiệu quả từ thử nghiệm pha III ROCKET AF | |||
| Dân số nghiên cứu | Phân tích ITT về hiệu quả trên bệnh nhân rung nhĩ không do bệnh lý van tim | ||
| Liều điều trị | Xarelto 20mg uống ngày 1 lần (15mg uống ngày 1 lần ở bệnh nhân có Crcl <50-30mL/phút) Tỷ lệ biến cố (100 bệnh nhân-năm) | Warfarin chuẩn độ đến mục tiêu INR 2,5 (giới hạn trị liệu 2,0 đến 3,0) Tỷ lệ biến cố (100 bệnh nhân năm) | Tỷ số rủi ro (Khoảng tin cậy 95%) giá trị p, test cho tính trội hơn |
| Đột quỵ thuyên tắc toàn thân ngoài hệ thần kinh trung ương |
269 (2.12) |
306 (2.42) |
0.88 (0.74-1.03) 0.117 |
| Đột quỵ thuyên tắc toàn thân ngoài hệ thần kinh trung ương, từ vong do bệnh mạch máu | 572 (4.51) | 609 (4.81) |
0.94 (0.84-1.05) 0.265 |
| Đột quỵ thuyên tắc toàn thân ngoài hệ thần kinh trung ương, tử vong do bệnh mạch máu, nhồi máu cơ tim | 659 (5.24) | 709 (5.65) |
0.93 (0.83-1.03) 0.158 |
| Đột quị | 253 (1.99) | 281 (2.22) |
0.90 (0.76-1.07) 0.221 |
| Thuyên tắc ngoài hệ thần kinh trung ương | 20 (0.16) | 27 (0.21) |
0.74 (0.42-1.32) 0.308 |
| Nhồi máu cơ tim | 130 (1.02) | 142 (1.11) |
0.91 (0.72-1.16) 0.464 |
Bảng 3: Kết quả về độ an toàn tử thử nghiệm pha III ROCKET AF
| Dân số nghiên cứu | Bệnh nhân rung nhĩ không do bệnh lý van tim | ||
| Liều điều trị |
Xarelto 20mg uống ngày 1 lần (15mg uống ngày 1 lần ở bệnh nhân có crcl: <50-30mL/phút) N=7061 Tỷ lệ biến cổ (100 bệnh nhân-năm) |
Warfarin chuẩn độ đến mục tiêu INR 2,5 (giới hạn trị liệu 2,0 đến 3,0) N=7082 Tỷ lệ biến cố (100 bệnh nhãn-năm) |
Tỷ số rủi ro (Khoảng tin cậy 95%) giá trị p |
| Các biến cố chảy máu liên quan lâm sàng nặng hoặc không nặng | 1475 (14,91) | 1449 (14,52) |
1,03 (0,96-1,11) 0,442 |
| Các biến cố chảy máu nặng | 395 (3,60) | 386 (3,45) |
1,04 (0,90-1,20) 0.576 |
| Tử vong** | 27 (0,24) | 55 (0,48) |
0,50 (0,31-0,79) 0.003 |
| Chảy máu ở cơ quan quan trọng** | 91 (0,82) | 133 (1,18) |
0,69 (0,53-0,91) 0.007 |
| Chảy máu nội sọ** | 55 (0,49) | 84 (0,74) |
0,67 (0,47-0,93) 0.019 |
| Giảm nồng độ hemoglobin** | 305 (2,77) | 254 (2,26) |
1,22 (1,03-1,44) 0.019 |
| Truyền 2 hoặc nhiều hơn 2 đơn vị hồng cầu lắng hoặc máu toàn phần** | 183 (1,65) | 149 (1,32) |
1,25 (1,01-1,55) 0.044 |
| Biến cố chảy máu liên quan lâm sàng không nặng | 1185 (11,80) | 1151 (11,37) |
1,04 (0,96-1,13) 0,345 |
a) dân số an toàn, trong điều trị
** Ít có ý nghĩa
+ SPAF: chuyển nhịp
Nghiên cứu thăm do tiến cứu, ngẫu nhiên, nhãn mở, đa trung tâm, đánh giá tiêu chí mù (X-VERT) được thực hiện trên 1504 bệnh nhân (không hoặc đã được điều trị trước đó với thuốc chống đông đường uống) có rung nhĩ không do van tim được chỉ định chuyển nhịp, so sánh rivaroxaban và kháng vitamin K chỉnh liều (tỉ lệ 2:1) trong phòng ngừa các biến cố tim mạch. Biện pháp chuyển nhịp gồm chuyển nhịp qua siêu âm qua thực quản TEE (1 – 5 ngày trước điều trị) hoặc chuyển nhịp quy ước (ít nhất 3 tuần trước điều trị). Tiêu chí hiệu quả chính (gồm tất cả các dạng đột quỵ, cơn thoáng thiếu máu não, tắc mạch hệ thống không phải thần kinh trung ương, nhồi máu cơ tim và tử vong tim mạch) xảy ra ở 5 bệnh nhân (0,5%) ở nhóm rivaroxaban (n=978) và 5 (1,0%) ở nhóm kháng vitamin K (n=492; RR 0,50; C1 95% 0,15 – 1,73; dân số dự kiến điều trị đã điều chỉnh). Tiêu chỉ an toàn chính (xuất huyết nặng) xây ra ở 6 bệnh nhân (0,6%) ở nhóm rivaroxaban (n=988) và 4 (0,8%) ở nhóm kháng vitamin K (n=499); (RR 0,76; (1 95% 0,21 – 2,67, dân số an toàn). Nghiên cứu thăm dò này cho thấy hiệu quả và an toàn tương đương giữa rivaroxaban và kháng vitamin K ở bệnh nhân chuyển nhịp.
+ Điều trị DVT và PE: Hiệu quả lâm sàng và độ an toàn
Chương trình nghiên cứu lâm sàng Xabantk được thiết kế để chứng minh hiệu quả của Xabantk trong điều trị khởi đầu và điều trị liên tục DVT và PE cấp tính và dự phòng DVT và PE.
Hơn 9.400 bệnh nhân được nghiên cứu trên ba nghiên cứu lâm sàng pha III, ngẫu nhiên có kiếm chứng (Einstein DVT, Einstein PE và Einstein Mở Rộng) và ngoài ra còn thực hiện thêm phân tích gộp được xác định trước của các nghiên cứu Einstein DVT và Einstein PC (xem Bảng 6).
Thời gian điều trị được kết hợp nói chung trên tất cả các nghiên cứu là 21 tháng
Trong nghiên cứu Einstein DVT, 3.449 bệnh nhân có DVT cấp tính được nghiên cứu để điều trị DVT và dự phòng tái phát DVT và PE. Thời gian điều trị lên đến 12 tháng tùy theo đánh giá lâm sàng của người nghiên cứu.
Trong 3 tuần đầu tiên điều trị DVT cấp tỉnh, Xabantk 15mg được chỉ định ngày 2 lần. Sau đó, sử dụng liều Xabantk 20mg ngày 1 lần.
Trong EINSTEIN PE, 4.832 bệnh nhân có PE cấp tính được nghiên cứu để điều trị PE và phòng ngừa DVT và PE tái phát. Thời gian điều trị lên đến 12 tháng tùy theo đánh giá làm sàng của bác sĩ nghiên cứu.
Đối với điều trị khỏi đầu PE cấp rivaroxaban 15mg được dùng hai lần mỗi ngày trong ba tuần.
Tiếp sau đó là rivaroxaban 20mg, một lần mỗi ngày.
Trong cả hai nghiên cứu EINSTEIN DVT và Einstein PE, phác đồ điều trị với thuốc so sánh gồm có enoxaparin dùng trong ít nhất 5 ngày phối hợp với điều
trị đối kháng vitamin K cho đến khi PT/INR nằm trong giới hạn điều trị ( >= 2,0). Điều trị tiếp tục bằng thuốc kháng vitamin K với liều được chỉnh để duy trì các giá trị PT/INR nằm trong khoảng điều trị 2,0 – 3,0.
Trong nghiên cứu Einstein mở rộng 1.197 bệnh nhân mắc DVT và PE được nghiên cứu để dự phòng tái phát DVT và PE. Thời gian điều trị lên đến 12 tháng tùy theo đánh giá lâm sàng của người nghiên cứu. Xabantk 20mg ngày 1 lần được so sánh với placebo.
Tất cả ba nghiên cứu pha III EINSTEIN đều dùng các tiêu chí về hiệu quả chính và phụ tương tự nhau được xác định trước. Tiêu chí chính đánh giá hiệu qu điều trị là VTE tái phát có triệu chứng được định nghĩa là hỗn hợp DVT tái phát hay PE gây tử vong hoặc không gây tử vong. Tiêu chí phụ đánh giá hiệu quả điều trị được định nghĩa là DVT tái phát, PE không gây tử vong và tử vong do mọi nguyên nhân.
Trong nghiên cứu EINSTEIN DVT (xem Bảng 4), đối với tiêu chí chính đánh giá hiệu quả, Xabantk cho thấy không kém hơn enoxaparin/VKA. NCB được định trước (tiêu chí đánh giá hiệu quả chính kết hợp các biến cố chảy máu nặng) đã được báo cáo với HR là 0,67 (khoảng tin cậy 95% = 0,47 – 0,95), giá trị p nhỏ (p=0,027) thuận lợi cho rivaroxaban. Tỷ lệ xuất hiện cho tiêu chí đánh giá an toàn chính (các biến cố chảy máu nặng hoặc không nặng về lâm sàng) cũng như tiêu chí phụ đánh giá độ an toàn (biến có chảy máu nặng) tương tự nhau ở cả hai nhóm điều trị.
Trong nghiên cứu EINSTEIN PE (xem Bảng 5) Xabantk được chứng minh là không kém hơn enoxaparin/VKA đối với tiêu chí đánh giá chính (p=0,0026 (test cho tính không kém hơn); tỉ lệ nguy cơ (HR): 1,12 (0,75 – 1,68)).
NCB được định rõ trước (kết cục hiệu quả chính cộng với các biến cố xuất huyết nặng) được báo cáo với HR là 0,85 ((95% (1= 0,63 – 1,14), giá trị p không đáng kể p=0,275).
Phân tích gặp kết cục được định rõ trước của các nghiên cứu EINSTEIN DVT và PE được thực hiện (xem Bảng 6).
Trong nghiên cứu EINSTEIN MỞ RỘNG (xem Bảng 7), Xabantk hiệu quả hơn so với placebo ở cả tiêu chí đánh giá hiệu quả chính và phụ. Đối với tiêu chí chính đánh giá độ an toàn (các biến có chảy máu nặng), tỷ lệ xuất hiện cao hơn không có ý nghĩa về số lượng cho bệnh nhân điều trị bằng Xabantk 20mg ngày 1 lần so với nhóm dùng placebo. Tiêu chí phụ đánh giá độ an toàn (các biến cố chảy máu nặng hoặc không nặng liên quan về lâm sàng) cho thấy tỷ lệ cao hơn đối với bệnh nhân điều trị bằng Xabantk 20mg ngày 1 lần so với placebo.
Bảng 4: Kết quả về hiệu quả và độ an toàn từ nghiên cứu pha III EINSTEIN DVT
| Dân số nghiên cứu | 3449 bệnh nhân bị huyết khối tĩnh mạch sâu cấp tính có triệu chứng | |
| Liều dùng và thời gian điều trị |
Xarelto 3,6 hoặc 12 tháng N=1731 |
Enoxaparin/VKA trong 5 ngày sau đó dùng VKA 3, 6 hoặc 12 tháng N-1718 |
| VTE tái phát có triệu chứng** | 36 (2,1%) | 51 (3,0%) |
| PE tái phát có triệu chứng | 20 (1,2%) | 18 (1,0%) |
| Triệu chứng tái phát DVT tái phát có triệu chứng | 14 (0,8%) | 28 (1,6%) |
| PE và DVT có triệu chứng | 1 (0,1%) |
0 |
| Tử vong do PE/Tử vong trong đó không loại trừ PE. | 4 (0,2%) | 6 (0,3%) |
| Chảy máu nặng hay chảy máu không nặng có liên quan về lâm sàng | 139 (8,19%) | 138 (8,1%) |
| Các biến cố chảy máu nặng | 14 (0,8%) | 20 (1,29%) |
|
Rivaroxaban 15mg ngày hai lần trong 3 tuần sau đó 20ng ngày một lần bị Enoxaparin trong ít nhất 5 ngày, được chồng chéo nhau với VKA và tiếp theo đó VKA *p<0.0001 (tính không kém hơn đối với hazard ratio được định rõ trước là 2.0); hazard ration: 0.680 (0.443-1,042), p=0.076 (tính trội hơn) |
||
Bảng 5: Các kết quả hiệu quả và an toàn từ nghiên cứu pha III EINSTEIN PE
| Dân số nghiên cứu | 4.832 bệnh nhân có thuyên tắc phối cấp có triệu chứng | |
| Liều và thời gian điều trị |
Xarelto 15mg BID trong 3 tuần, tiếp theo là 20mg od 3,6 hay 12 tháng N-2419 |
Enoxaparin trong 5 ngày tiếp theo là VKA 3, 6 hoặc 12 tháng N=2413 |
| VIE tái phát có triệu chứng” | 50 (2,1%) | 44 (1,8%) |
| PE tái phát có triệu chứng | 23 (1,0%) | 20 (0,8%) |
| DVT tái phát có triệu chứng | 18 (0,7%) | 17 (0,7%) |
| PE và DVT có triệu chứng | 0 | 2 (<0,1%) |
| Pt tử vong/ tử vong khi chưa loại trừ được PE | 11 (0,5%) | 7 (0,3%) |
| Biến cố xuất huyết nặng | 26 (1,1%) | 52 (2,29%) |
| *p<0,0026 (không kém hơn); HR: 1,12 (0,75-1,68) | ||
Bảng 6: Các kết quả gộp về hiệu quả và an toàn từ các nghiên cứu Einstein pha III, EINSTEIN DVT và EINSTEIN PE
| Dân số nghiên cứu | 8.281 bệnh nhân có huyết khối tĩnh mạch sâu hoặc thuyên tắc phối cấp có triệu chứng | |
| Liều lượng và thời gian điều trị |
Xarelto 15mg BID trong 3 tuần, tiếp theo là 20mg od 3,6 hay 12 tháng N=4150 |
Enoxaparin trong 5 ngày tiếp theo là VKA 3, 6 hay 12 tháng N=4131 |
| VTE tái phát có triệu chứng” | 86 (2,1%) | 95 (2,3%) |
| PE tái phát có triệu chứng | 43 (1,0%) | 38 (0,9%) |
| DVT tái phát có triệu chứng | 32 (0,8% | 45 (1.1%) |
| PE và DVT có triệu chứng | 1 (<0,1%) | 2 (<0,1%) |
| PE tử vong/tử vong khi chưa loại trừ được PE | 15 (0,4%) | 13 (0,3%) |
| Biển có xuất huyết nặng | 40 (1.0%) | 72 (1.7%) |
| *p<0,001 (không kém hơn); HR: 0,89 (0,66-1,19) | ||
Bảng 7: kết quả về hiệu quả và độ an toàn từ nghiên cứu pha III EINSTEIN MỞ RỘNG
| Dân số nghiên cứu | 1197 bệnh nhân tiếp tục điều trị và dự phòng tái phát thuyền tắc huyết khối tĩnh mạch | |
| Liều dùng và thời gian điều trị |
Xarelto 20mg ngày 1 lần trong 6 hoặc 12 tháng N=602 |
Placebo trong 6 hoặc 12 tháng N=594 |
| VTE tái phát có triệu chứng” | 8 (1,3%) | 42 (7,1%) |
| PE tái phát có triệu chứng | 2 (0,3%) | 13 (0,8%) |
| DVT tái phát có triệu chứng | 5 (2,2%) | 31 (5,2%) |
| Tử vong do PE/Tử vong trong đó không loại trừ PE | 1 (0,2%) | 1 (0,2%) |
| Các biến cố chảy máu nặng | 4 (0,7%) | 0 (0,0%) |
| *p<0,001 (trội hơn), HR: 0,19 (0,09–0,39) | ||
+ Ảnh hưởng lên khoảng QTc: Không ghi nhận tác dụng kéo dài khoảng QTC ở nam và nữ giới khỏe mạnh trên 50 tuổi.
Hấp thu và sinh khả dụng:
Rivaroxaban được hấp thu nhanh, với nồng độ tối đa (Cmax) sau 2 – 4 giờ uống thuốc.
Rivaroxaban hấp thu hầu như hoàn toàn qua đường uống và sinh khả dụng đường uống cao (80-100%) với viên 10mg, bất kể uống thuốc ở tình trạng đói/no. Việc sử dụng thuốc cùng với thức ăn không làm ảnh hưởng đến AUC hoặc Cmax của rivaroxaban ở liều 10mg. Xabantk có thể dùng cùng hoặc không cùng với thức ăn (xem phần “Liêu lượng và Cách dùng”).
Do mức độ hấp thu giảm, sinh khả dụng đường uống của viên Xabantk 20mg uống lúc đói chỉ đạt 66%. Khi uống Xabantk 20mg cùng với thức ăn làm tăng AUC trung bình 39% so với khi uống thuốc vào lúc đói, cho thấy thuốc hấp thu hầu như hoàn toàn và có sinh khả dụng đường uống cao (xem phần “Liều lượng và Cách dùng”).
Ở tình trạng no, sự hấp thu của viên Xabantk 10mg, 15mg, 20mg tỷ lệ thuận với liều dùng.
Tính biến thiên trong dược động học của rivaroxaban vừa phải với tính biến thiên giữa các cá thể (CV%) trong giới hạn từ 30% đến 40%. Sự hấp thu rivaroxaban tùy thuộc vào vị trí phóng thích thuốc trong đường tiêu hóa. Giảm 29% và 56% AUC và Cmax được so sánh đối với viên thuốc được báo cáo khi rivaroxaban nghiên nhỏ được phóng thích trong đoạn gần của ruột non. Sự phơi nhiễm còn giảm thêm khi thuốc được phóng thích trong đoạn xa của ruột non, hay trong đại tràng lên. Tránh dùng rivaroxaban xa với dạ dày có thể dẫn đến giảm sự hấp thu và sự phơi nhiễm liên quan đến thuốc
Tính sinh khả dụng (AUC và Cmax) có thể so sánh đối với rivaroxaban 20mg nghiền ra dùng cho đường uống trộn với nước táo hay dịch treo trong nước
và dùng qua ống thông dạ dày tiếp theo là thức ăn lỏng, được so sánh với uống nguyên viên thuốc. Đặc điểm dược lực học của rivaroxaban có thể dự đoán, tỉ lệ với liều, nên các kết quả sinh khả dụng từ nghiên cứu này có thể áp dụng cho các liệu rivaroxaban thấp hơn.
Phân bố:
Gắn kết protein trong huyết tương ở người cao, xấp xỉ khoảng 92% đến 95% với albumin huyết tương là thành phần gắn kết chính. Thể tích phân bố ở mức trung bình với Vss khoảng 50L
Chuyển hóa và thái trừ
Trong liều rivaroxaban uống vào có khoảng 2/3 liều bị thoái biến theo chuyển hóa, với một nửa sau đó được thải trừ qua thận và một nửa kia bị thải trừ qua đường phân. 1/3 liều dùng còn lại thải trừ trực tiếp qua thận dưới dạng hoạt chất không đổi trong nước tiểu, phần lớn qua sự bài tiết chủ động của thận.
Rivaroxaban được chuyển hóa qua các cơ chế CYP 3A4, CYP 2/2 và cơ chế không phụ thuộc CYP Sự thoái biến do oxyd hóa nhóm morpholinone và thủy phân các liên kết amide là các vị trí chủ yếu của sự biến đổi sinh học. Theo các nghiên cứu in vitro thì rivaroxaban là một chất nền của các protein vận chuyển P-gp (P-glycoprotein) và Bcp (protein kháng ung thư vú).
Rivaroxaban ở dạng không đổi là hợp chất quan trọng nhất trong huyết tương người với sự có mặt của các chất chuyển hóa không quan trọng hoặc có hoạt tính đang lưu hành. Độ thanh thải toàn phần của rivaroxaban là khoảng 10 L/giờ, được xếp vào nhóm thuốc có độ thanh thải thấp. Sự thải trừ rivaroxaban khỏi huyết tương xảy ra với thời gian bán thải khoảng 5-9 giờ ở người trẻ và khoảng 11-13 giờ ở người già.
Bệnh nhân lão khoa
Ở bệnh nhân cao tuổi, nồng độ thuốc trong huyết tương cao hơn ở người trẻ tuổi với giá trị AUC trung bình cao hơn xấp xỉ gấp 1,5
lần, phần lớn do giảm (rõ ràng) độ thanh thải toàn phần và độ thanh thải qua thận (xem phần “Liều lượng và Cách dùng”).
Giới tính:
Giữa bệnh nhân nam và nữ không có sự khác biệt về được động học trên lâm sàng (xem phần “Liều lượng và Cách dùng”).
Cân nặng:
Các mức thái cực của cần nặng cơ thể (< 50kg so với > 120kg) chỉ có ảnh hưởng nhỏ lên nồng độ rivaroxaban trong huyết tương (< 25%) (xem phần “Liều lượng và Cách dùng”).
Trẻ em và thanh thiếu niên:
Độ an toàn và hiệu quả của thuốc ở trẻ em và thanh thiếu niên dưới 18 tuổi chưa được thiết lập (xem phần “Liều lượng và Cách dùng”).
– Sự khác biệt về dân tộc:
Không có sự khác nhau về dược động học và dược lực học liên quan lâm sàng giữa các bệnh nhân da trắng, người Mỹ gốc Phi, Tây ban nha hoặc Bồ đào nha, Nhật bản và Trung Quốc (xem phần “Liều lượng và Cách dùng”).
– Suy giảm chức năng gan
Ảnh hưởng của sự suy giảm chức năng gan lên được động học của rivaroxaban được nghiên cứu trên các đối tượng được phân nhóm theo hệ thống xếp loại Child Pugh, một quy trình chuẩn trong phát triển lâm sàng. Mục đích ban đầu của xếp loại Child Pugh là đánh giá tiền lượng bệnh gan mạn tính, chủ yếu là xơ gan. Ở bệnh nhân dự định dùng thuốc chống đông, điều quan trọng của suy giảm chức năng gan là giảm tổng hợp các yếu tố đông máu bình thường ở gan. Vì điều này chỉ đo được nhờ một trong năm đo lường làm sàng hóa sinh trong hệ thống phân loại Child Pugh, nên không có mối tương quan rõ ràng giữa nguy cơ chảy máu ở bệnh nhân với sự sắp xếp phân loại của hệ thống này. Do đó, quyết định điều trị thuốc chống đồng cho bệnh nhân phải độc lập với xếp loại Child Pugh.
Chống chỉ định Xabantk ở các bệnh nhân mắc bệnh gan đi kèm với bệnh đông máu, dẫn đến nguy cơ chảy máu liên quan lâm sàng (xem phần “Chống chỉ định”).
Ở bệnh nhân xơ gan suy giảm chức năng gan ở mức độ nhẹ (được xếp loại Child Pugh A) được động học của rivaroxaban chỉ thay đổi nhỏ (trung bình AUC của rivaroxaban tăng 1,2 lần), gần như tương đương với mức đạt được ở nhóm đối chứng khỏe mạnh. Không ghi nhận thấy sự khác biệt có liên quan về đặc tính được lực học giữa các nhóm này.
Ở bệnh nhân xơ gan suy giảm chức năng gan ở mức độ trung bình (được xếp loại Child Pugh B), AUC trung bình của rivaroxaban tăng đáng kể, gấp 2,3 lần so với ở người tình nguyện khỏe mạnh do sự thanh thải thuốc giảm đi đáng kể thể hiện bệnh gan rõ rệt. AUC không gắn kết tăng gấp 2,6 lần. Không có dữ liệu ở bệnh nhân suy giảm chức năng gan nặng.
Sự ức chế hoạt động của yếu tố Xa tăng gấp 2,6 lần so với trên người tình nguyện khỏe mạnh; sự kéo dài PT tương tự tăng gấp 2,1 lần. PT trong xét nghiệm đồng máu toàn bộ đánh giá con đường ngoại sinh bao gồm các yếu tố đông máu VII, X, V, II và I được tổng hợp ở gan. Bệnh nhân suy giảm chức năng gan ở mức độ trung bình thường nhạy cảm hơn với rivaroxaban, dẫn đến đô thị biểu diễn mối quan hệ Dược động học/Dược lực học (PK/PD) giữa nồng độ và PT trở nên dốc đứng hơn.
Hiện không có dữ liệu về các bệnh nhân Child Pugh C (xem phần “Liều lượng và Cách dùng”, “Chống chỉ định”).
– Suy giảm chức năng thận
Sự phơi nhiễm của rivaroxaban tăng lên ngược lại với sự giảm chức năng thận được đánh giá qua độ thanh thải creatinine.
Ở bệnh nhân suy giảm chức năng thận ở mức độ nhẹ (CrC; < 80 – 50mL/phút), trung bình (GC: < 50 – 30mL/phút) và nặng (CrCl < 30 – 15mL/phút), nồng độ rivaroxaban trong huyết thanh (AUC) lần lượt tăng gấp 1,4, 1,5 và 1,6 lần so với ở người tình nguyện khỏe mạnh (xem phần “Liều lượng và Cách dùng”. “Cảnh báo”).
Sự tăng tác dụng được lực học tương ứng rõ rệt hơn (xem phần “Liều lượng và Cách dùng”, “Cảnh báo”).
Ở bệnh nhân suy giảm chức năng thận ở mức độ nhẹ, trung bình và nặng, sự ức chế hoạt động của yếu tố Xa nói chung tăng lần lượt gấp 1,5 1,9 và 2,0
lần so với ở người tình nguyện khỏe mạnh, sự kéo dài PT tương tự tăng tương ứng là gấp 1,3; 2,2 và 2,4 lần.
Không có dữ liệu về bệnh nhân có GI < 15mL/phút
Khuyến cáo không sử dụng thuốc ở bệnh nhân có độ thanh thải creatinine < 15mL/phút. Nên thận trọng khi sử dụng Xabantk ở bệnh nhân suy giảm chức
năng thận nặng có độ thanh thải creatinine 15 – 30mL/phút. (xem phần “Liều lượng và Cách dùng”, “Cảnh báo”).
Do bởi bệnh nên, nên những bệnh nhân có suy giảm chức năng thận nặng có nguy cơ tăng cả chảy máu và huyết khối.
Mục lục
Toggle Hộp 3 vỉ x 10 viên
Hộp 3 vỉ x 10 viên Hộp 6 vỉ x 10 viên
Hộp 6 vỉ x 10 viên Hộp 1 lọ x 20ml
Hộp 1 lọ x 20ml Hộp 2 vỉ x 7 viên
Hộp 2 vỉ x 7 viên Hộp 1 lọ x 45ml
Hộp 1 lọ x 45ml Hộp 3 vỉ x 10 viên
Hộp 3 vỉ x 10 viên










Chưa có đánh giá nào.