| Công dụng | Điều trị động kinh |
| Đối tượng sử dụng | Trẻ em từ 2 tuổi trở lên |
| Mang thai & Cho con bú | Không được dùng |
| Cách dùng | Uống sau bữa ăn |
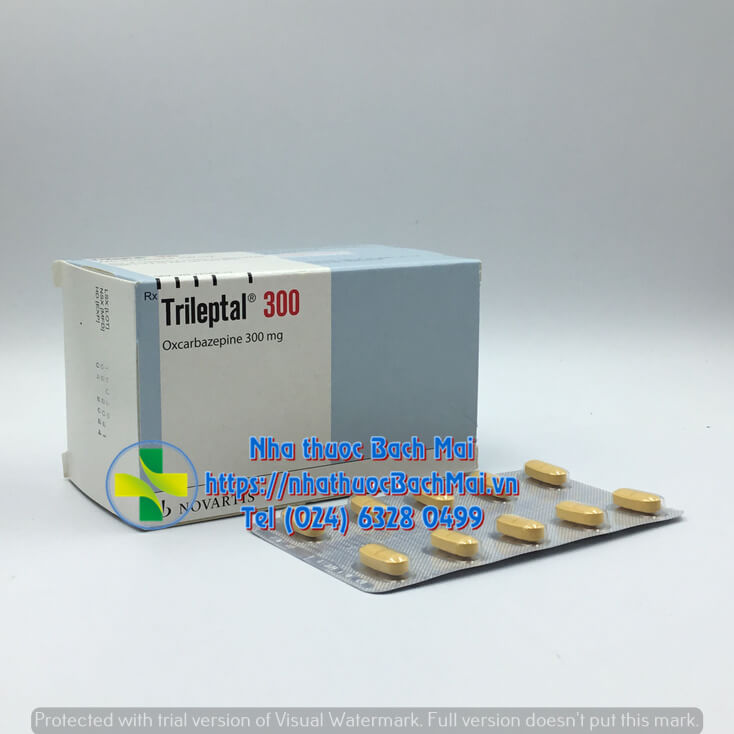
| Hoạt chất | Oxcarbazepine |
| Danh mục | Thuốc chống co giật |
| Thuốc kê đơn | Có |
| Xuất xứ | Italy |
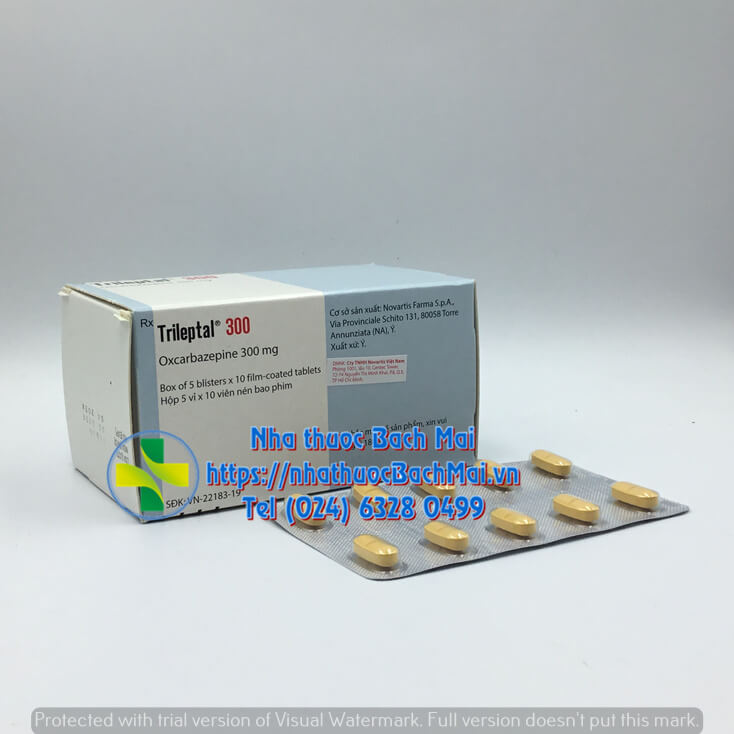
| Quy cách | Hộp 5 vỉ x 10 viên |
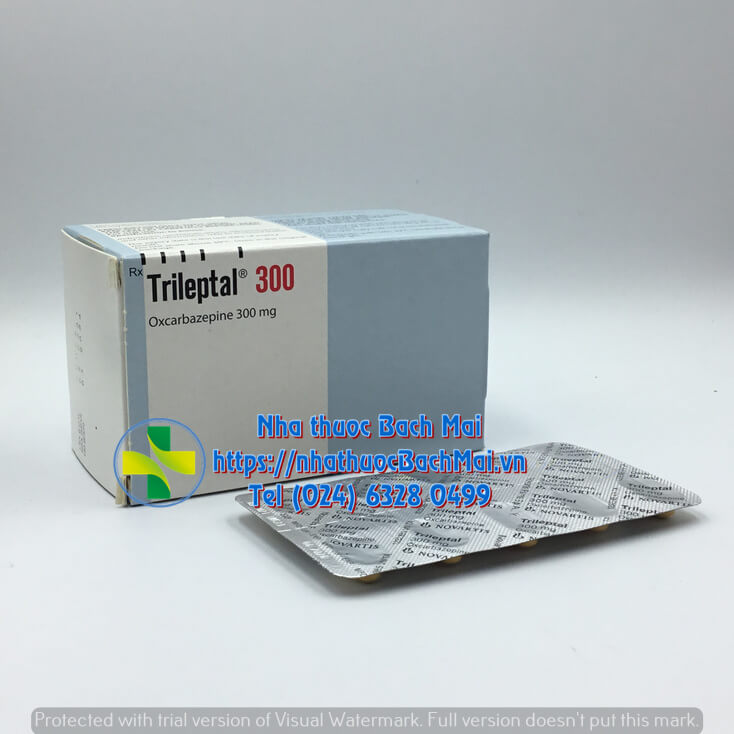
| Dạng bào chế | Viên nén bao phim |
| Thương hiệu | Novartis |
| Mã SKU | SP00216 |
| Hạn dùng | 36 tháng kể từ ngày sản xuất |
| Số đăng ký | VN-22183-19 |
Thuốc Trileptal 300 chỉ định điều trị các rối loạn co giật (động kinh). Trileptal 300 có thể được sử dụng với thuốc chống động kinh khác theo chỉ định của bác sĩ.
Nhà thuốc Bạch Mai cam kết
Bạn đang muốn tìm hiểu về thuốc Trileptal 300 được chỉ định điều trị cho bệnh gì? Những lưu ý quan trọng phải biết trước khi dùng thuốc Trileptal 300 và giá bán thuốc Trileptal 300 tại hệ thống nhà thuốc Bạch Mai?. Hãy cùng Nhà thuốc Bạch Mai tham khảo thông tin chi tiết về thuốc Trileptal 300 qua bài viết ngay sau đây nhé !
Trileptal 300 là thuốc dùng theo đơn, được chỉ định điều trị các rối loạn co giật (động kinh). Trileptal 300 có thể được sử dụng với thuốc chống động kinh khác theo chỉ định của bác sĩ.
Thành phần hoạt chất: Mỗi viên nén bao phim Trileptal chứa 300 mg oxcarbazepine.
Thành phần tá dược Lớp lõi: silica dạng keo khan; cellulose vi tinh thể; hypomellose, crospovidone, magnesi stearate; Lớp bao: hypomellose, talc, titan dioxide (E 171); macrogol 8000; oxid sắt vàng (E172).
DẠNG BÀO CHẾ: Viên nén bao phim.
Viên nén hình thuôn hai mặt hơi lồi, màu vàng, có vạch ở 2 mặt. Chạm chữ TE/TE ở một mặt và chữ CG/CG ở mặt kia.
QUI CÁCH ĐÓNG GÓI: Hộp 5 vỉ x 10 viên nén bao phim.
Trileptal được chỉ định trong đơn trị liệu hoặc điều trị phối hợp trong điều trị động kinh cục bộ ở người lớn và đơn trị liệu trong điều trị động kinh cục bộ ở trẻ em từ 4 tuổi trở lên có cơn co giật, và trong điều trị phối hợp cho trẻ em từ 2 tuổi trở lên có động kinh cục bộ.
Điều trị phối hợp ở người lớn
Bắt đầu dùng Trileptal với liều 600 mg/ngày, chia làm hai lần một ngày. Nếu được chỉ định lâm sàng, liều có thể được tăng thêm một lượng tối đa mỗi 600 mg/ngày với khoảng dưới 20 kg, có thể xem xét liều bắt đầu từ 16 tới 20 mg/kg (xem phần ĐẶC TÍNH DƯỢC ĐỘNG HỌC và ĐẶC TÍNH DƯỢC LỰC HỌC). Liều duy trì tối đa của Trileptal nên đạt được trong vòng từ 2 đến 4 tuần và không được vượt quá 60 mg/kg/ngày với chế độ hiểu hai lần một ngày.
Trong thử nghiệm lâm sàng ở trẻ em (2 đến 4 tuổi) mà dự định đạt được liều mục tiêu là 60 mg/kg/ngày, 50% các bệnh nhân đạt được liều cuối cùng tối thiểu là 55 mg/kg/ngày. Trong điều trị phối hợp (có hoặc không có thuốc chống động kinh cảm ứng enzyme), khi đã bình thường hóa theo thể trọng, thì độ thanh thải biểu kiến (L/giờ/kg) giảm trong khi độ tuổi tăng lên, như vậy trẻ em từ 2 đến <4 tuổi có thể cần gấp đôi liều oxcarbazepine theo thể trọng khi so sánh với người lớn; và trẻ em tuổi từ 4 tới <12 có thể cần liều oxcarbazepine theo thể trọng cao hơn 50% so với người lớn.
Chuyển đổi sang đơn trị liệu cho trẻ em (từ 4 đến 16 tuổi)
Bệnh nhân dùng phối hợp các thuốc chống động kinh có thể được chuyển sang đơn trị liệu bằng cách bắt đầu điều trị bằng Trileptal với liều từ 8 đến 10 mg/kg/ngày chia làm hai lần, trong khi đồng thời bắt đầu giảm liều thuốc chống động kinh kèm theo. Việc dùng phối hợp các thuốc động kinh có thể được ngưng hoàn toàn trong vòng 3 đến 6 tuần trong khi liều Trileptal có thể tăng lên theo chỉ định lâm sàng với mức tăng liều tối đa là 10 mg/kg/ngày với khoảng cách tăng liều là xấp xỉ một tuần để đạt được liều lượng hàng ngày khuyến cáo. Bệnh nhân nên được theo dõi chặt chẽ trong giai đoạn chuyển tiếp này.
Tổng liều dùng hàng ngày khuyến cáo của Trileptal được thể hiện trong Bảng 1 dưới đây.
Khởi đầu đơn trị liệu cho bệnh nhân trẻ em (từ 4 đến 16 tuổi)
Bệnh nhân đang không được điều trị bằng các thuốc chống động kinh có thể dùng đơn trị liệu bắt đầu với Trileptal. Ở những bệnh nhân này, bắt đầu dùng Trileptal với liều từ 8 đến 10 mg/kg/ngày chia hai lần một ngày. Liều nên được tăng là 5 mg/kg/ngày sau mỗi 3 ngày theo liều lượng hàng ngày được khuyến cáo như trong bảng dưới đây.
Bảng 1: Khoảng liều duy trì của Trileptal cho trẻ em theo cân nặng trong đơn trị liệu
| Cân nặng theo kg | Từ | Đến |
| Liều (mg/kg) | Liều (mg/kg) | |
| 20 | 600 | 900 |
| 25 | 900 | 1200 |
| 30 | 900 | 1200 |
| 35 | 900 | 1500 |
| 40 | 900 | 1500 |
| 45 | 1200 | 1500 |
| 50 | 1200 | 1800 |
| 55 | 1200 | 1800 |
| 60 | 1200 | 2100 |
| 65 | 1200 | 2100 |
cách giữa các lần xấp xỉ 1 tuần, liều tối đa hàng ngày khuyến cáo là 1200 mg/ngày. Liều hàng ngày trên 1200 mg/ngày cho thấy hiệu quả cao hơn trong thử nghiệm có đối chứng, tuy nhiên hầu hết bệnh nhân không có khả năng dung nạp được liều 2400 mg/ngày, chủ yếu là do các tác dụng lên hệ thần kinh trung ương. Khuyến cáo cần theo dõi chặt chẽ bệnh nhân và nồng độ trong huyết tương của các thuốc chống động kinh khi dùng đồng thời trong giai đoạn định liều Trileptal, do những nồng độ này có thể bị thay đổi, đặc biệt ở liều Trileptal lớn hơn 1200 mg/ngày (xem phần TƯƠNG TÁC THUỐC).
Chuyển đổi sang đơn trị liệu ở người lớn
Bệnh nhân sử dụng đồng thời các thuốc chống động kinh có thể được chuyển sang dùng đơn trị liệu bằng cách bắt đầu điều trị bằng Trileptal với liều 600 mg/ngày (liều chia thành 2 lần một ngày) trong khi đồng thời bắt đầu giảm liều thuốc chống động kinh kèm theo. Các thuốc chống động kinh dùng đồng thời nên được ngưng dùng hoàn toàn trong vòng từ 3 đến 6 tuần, trong khi liều tối đa của Trileptal nên đạt được sau khoảng từ 2 đến 4 tuần. Liều Trileptal có thể được tăng lên theo chỉ định lâm sàng với mức tăng tối đa là 600 mg/ngày với khoảng cách giữa các lần là xấp xỉ 1 tuần để đạt được liều tối đa khuyến cáo dùng hàng ngày là 2400 mg/ngày. Liều hàng ngày 1200 mg/ngày đã được chứng minh trong một nghiên cứu là có hiệu quả ở những bệnh nhân dùng đơn trị liệu bắt đầu với Trileptal. Bệnh nhân nên được theo dõi chặt chẽ trong giai đoạn chuyển tiếp này.
Khởi đầu đơn trị liệu ở người lớn
Bệnh nhân đang không được điều trị với các thuốc chống động kinh có thể được bắt đầu đơn trị liệu với Trileptal. Ở những bệnh nhân này, bắt đầu dùng Trileptal với liều 600 mg/ngày (chia làm hai lần một ngày); liều nên được tăng thêm 300 mg/ngày sau mỗi 3 ngày cho tới liều 1200 mg/ngày. Các thử nghiệm đối chứng ở những bệnh nhân này đã kiểm tra hiệu quả của liều 1200 mg/ngày; liều dùng 2400 mg/ngày đã được chứng minh là có hiệu quả trên những bệnh nhân chuyển từ các thuốc chống động kinh khác sang đơn trị liệu bằng Trileptal (xem ở trên).
Điều trị phối hợp cho trẻ em (từ 2 đến 16 tuổi)
Ở những bệnh nhân trẻ em từ 4 đến 16 tuổi, bắt đầu dùng Trileptal với liều hàng ngày từ 8 đến 10 mg/kg thường không vượt quá 600 mg/ngày, chia làm hai lần một ngày. Liều duy trì đích của Trileptal nên đạt được trong 2 tuần và phụ thuộc vào cân nặng của bệnh nhân, theo biểu đồ sau:
20 đến 29 kg – 900mg/ngày
29,1 đến 39 kg – 1200mg/ngày
>39 kg – 1800mg/ngày
Trong thử nghiệm lâm sàng, với dự định đạt được các liều mục tiêu này, liều trung bình hàng ngày là 31 mg/kg với khoảng liều từ 6 tới 51 mg/kg.
Ở trẻ em từ 2 đến dưới 4 tuổi, bắt đầu dùng Trileptal ở liều hàng ngày từ 8 tới 10 mg/kg thường không vượt quá 600 mg/ngày, chia làm hai lần một ngày. Với những bệnh nhân
| 70 | 1500 | 2100 |
Điều chỉnh liều cho bệnh nhân suy thận
Đối với bệnh nhân suy chức năng thận (độ thanh thải creatinine dưới 30 mL/phút), khởi đầu dùng Trileptal với liều bằng nửa liều khởi đầu thường dùng (300 mg/ngày, chia hai lần trên ngày) và tăng liều lần để đạt được đáp ứng lâm sàng mong muốn (xem mục ĐẶC TÍNH DƯỢC LỰC HỌC và ĐẶC TÍNH DƯỢC ĐỘNG HỌC).
Thông tin sử dụng
Các viên nén được rạch khía nên có thể bẻ gãy thành hai nửa viên, giúp cho bệnh nhân dễ nuốt viên thuốc hơn. Với trẻ em nhỏ tuổi hoặc những bệnh nhân không thể nuốt được viên thuốc hoặc liều dùng không cho phép sử dụng viên nén, có thể sử dụng Trileptal dạng hỗn dịch có sẵn trên thị trường. Hỗn dịch uống Trileptal và viên nén bao phim Trilental là tương đương sinh học và có thể được chuyển đổi với liều lượng bằng nhau (xem phần ĐẶC TÍNH DƯỢC ĐỘNG HỌC và ĐẶC TÍNH DƯỢC LỰC HỌC). Trileptal có thể được dùng kèm hoặc không kèm với thức ăn (xem phần ĐẶC TÍNH DƯỢC ĐỘNG HỌC và ĐẶC TÍNH DƯỢC LỰC HỌC).
Hướng dẫn sử dụng, xử lý và hủy bỏ
Trileptal phải được để xa tầm tay và tầm nhìn của trẻ em.
Quá mẫn với oxcarbazepine hoặc eslicarbazepine hoặc bất kỳ thành phần tá dược nào của Trileptal.
Quá mẫn cảm
Phản ứng quá mẫn cảm loại I (tức thì) bao gồm nổi ban, ngứa, nổi mề đay, phù mạch và các báo cáo về phản vệ đã được ghi nhận trong giai đoạn hậu mãi. Đã có báo cáo về các trường hợp phản vệ và phù mạch bao gồm cả thanh quản, thanh môn, môi và mí mắt ở bệnh nhân sau khi uống các liều Trileptal đầu tiên hoặc các liều kế tiếp. Nếu bệnh nhân gặp các phản ứng này sau khi điều trị bằng Trileptal, phải ngừng dùng thuốc và bắt đầu điều trị bằng một thuốc khác.
Bệnh nhân đã từng có phản ứng quá mẫn với carbamazepine nên được thông báo trước rằng khoảng 25-30% số bệnh nhân này có thể mẫn cảm với Trileptal (xem phần PHẢN ỨNG BẤT LỢI).
Phản ứng quá mẫn cảm, bao gồm quá mẫn cảm ở nhiều cơ quan cũng có thể xảy ra ở những bệnh nhân không có tiền sử quá mẫn cảm với carbamazepine. Những phản ứng này có thể ảnh hưởng đến da, gan, máu, hệ bạch huyết hoặc các cơ quan khác, xảy ra riêng lẻ hoặc kết hợp với nhau trong bệnh cảnh phản ứng toàn thân (xem phần PHẢN ỨNG BẤT LỢI). Nói chung, nếu có dấu hiệu và triệu chứng gợi ý về phản ứng quá mẫn cảm thì phải ngừng Trileptal ngay lập tức.
Tác dụng trên da
Khi sử dụng Trileptal, rất hiếm gặp các phản ứng ngoài da nghiêm trọng, bao gồm hội chứng Stevens-Johnson, hoại tử biểu bì nhiễm độc (hội chứng Lyell) và ban đỏ đa dạng. Bệnh nhân nào bị các phản ứng ngoài da nghiêm trọng có thể phải nằm viện, vì những tình trạng này có thể đe dọa tính mạng và tử vong (tuy rất hiếm). Những phản ứng trên do dùng Trileptal gặp cả ở trẻ em và người lớn. Thời gian trung bình để bắt đầu phản ứng là 19 ngày. Cũng gặp một số trường hợp tái phát phản ứng nghiêm trọng ngoài da khi dùng lại Trileptal. Khi bệnh nhân gặp phản ứng ngoài da với Trileptal, cần cân nhắc ngừng dùng Trileptal và thay thế bằng thuốc chống động kinh khác.
Gen dược học
Ngày càng có nhiều bằng chứng cho thấy các gen đồng vị khác nhau (alen) của kháng nguyên tế bào bạch cầu ở người (HLA) đóng vai trò liên quan đến các phản ứng phụ trên da ở những bệnh nhân dễ mắc.
Liên quan đến HLA-B*1502
Các nghiên cứu hồi cứu ở bệnh nhân người Hán gốc Trung Quốc và người gốc Thái cho thấy mối tương quan mạnh giữa các phản ứng da SJS/TEN do carbamazepine và những bệnh nhân có kháng nguyên bạch cầu người HLA-B*1502.
Bởi vì cấu trúc hóa học của oxcarbazepine tương tự với cấu trúc của carbamazepine, có khả năng cho rằng những bệnh nhân mang gen đồng vị HLA-B*1502 cũng gia tăng nguy cơ phản ứng da SJS/TEN với oxcarbazepine.
Tần số của gen đồng vị HLA-B*1502 là 2-12% dân số người Hán Trung Hoa, khoảng 8% người dân Thái, hơn 15% ở Philipine và một số người Mã Lai. Tần số gen đồng vị này lên đến lần lượt là 2% ở Hàn Quốc và 6% ở Ấn Độ. Tần số của HLA-B*1502 thì không đáng kể ở những người gốc Châu Âu, một vài chủng tộc ở Châu Phi, người Mỹ bản xứ, người gốc Tây Ban Nha và ở Nhật Bản (<1%).
Tần số gen đồng vị được liệt kê ở đây đại diện cho phần trăm nhiễm sắc thể ở những dân số đặc biệt mà có gen đồng vị này, nghĩa là phần trăm mà bệnh nhân mang bản sao của gen đồng vị này trên ít nhất 1 trong hai nhiễm sắc thể của chúng (tần số người mang”) là cao gần gấp đôi tần số của gen đồng vị. Vì vậy phần trăm bệnh nhân có nguy cơ thì gần gấp đôi tần số gen đồng vị.
Kiểm tra sự hiện diện của gen đồng vị HLA-B* 1502 nên được xem xét ở các bệnh nhân có tổ tiên thuộc nhóm dân số nguy cơ về mặt di truyền, trước khi khởi đầu điều trị bằng Trileptal (xem thông tin dành cho chuyên gia y tế bên dưới). Trileptal nên được tránh dùng cho các bệnh nhân mà kết quả thử nghiệm cho thấy dương tính với HLA-B*1502 trừ khi lợi ích vượt trội nguy cơ. HLA-B*1502 có thể là một yếu tố nguy cơ của sự phát triển SJS/TEN ở dân số Trung Hoa sử dụng các thuốc chống động kinh khác (AED) liên quan đến SJS/TEN. Vì vậy cần xem xét tránh dùng các thuốc liên quan đến SJS/TEN ở những bệnh nhân dương tính HLA-B*1502, khi liệu pháp điều trị thay thế khác được chấp nhận. Việc tầm soát không được khuyến cáo thực hiện với những nhóm bệnh nhân có tần số HLA-B*1502 thấp hoặc những bệnh nhân đang sử dụng Trilental, bởi vì nguy cơ của SJS/TEN giới hạn trong vài tháng đầu điều trị bất kể tình trạng của HLA-B*1502.
Liên quan đến HLA-A*3101
Kháng nguyên bạch cầu người (HLA)-A*3101 có thể là một yếu tố nguy cơ cho các phản ứng phụ ở da như SJS, TEN, DRESS, AGEP và chứng phát ban dát sẩn. Tần số của gen đồng vị HLA-A*3101 thay đổi đa dạng giữa các dân tộc và tần số của nó vào khoảng 2 đến 5% ở dân số Châu Âu và khoảng 10% ở người Nhật. Tần số của gen đồng vị này ước đoán ít hơn 5% ở đa số dân ở Úc, Châu Á, Châu Phi và Bắc Mỹ với một vài ngoại lệ là từ 5 – 12%. Tần số hơn 15% được ước lượng ở một số nhóm dân tộc như Nam Mỹ (Argentina và Brazil), Bắc Mỹ (thổ dân Navajo, Sioux và Mexico Sonora Seri) và Nam Ân (Tamil Nadu) và giữa 10 -15% ở các dân tộc bản địa trong cùng khu vực.
Tần số gen đồng vị được liệt kê ở đây đại diện cho phần trăm nhiễm sắc thể ở những dân số đặc biệt mà có gen đồng vị này, nghĩa là phần trăm mà bệnh nhân mang bản sao của gen đồng vị này trên ít nhất 1 trong hai nhiễm sắc thể của chúng (tần số người mang”) là cao gần gấp đôi tần số của gen đồng vị. Vì vậy phần trăm bệnh nhân có nguy cơ gần gấp đôi tần số gen đồng vị.
Có số liệu cho rằng HLA-A*3101 liên quan đến sự gia tăng nguy cơ phản ứng phụ trên da do carbamazepine bao gồm SJS, TEN, chứng phát ban bởi thuốc kết hợp với tăng bạch cầu ưa acid do dị ứng, hoặc chứng phát ban mụn mủ cấp tính ít nghiêm trọng (AGEP) và phát ban dát sẩn.
Không đủ dữ liệu củng cố cho khuyến cáo tiến hành thử nghiệm sự hiện diện của gen đồng vị HLA-A*3101 ở bệnh nhân trước khi khởi đầu điều trị với oxcarbazepine. Kiểm tra di truyền không khuyến cáo tiến hành cho bệnh nhân đang dùng Trileptal, bởi vì nguy cơ của SJS, TEN, DRESS và phát ban dát sẩn giới hạn phạm vi trong vài tháng đầu điều trị, bất kể tình trạng của HLA-A*3101.
Giới hạn của tầm soát di truyền
Kết quả của tầm soát di truyền không bao giờ thay thế cho cảnh giác lâm sàng thích hợp và quản lý bệnh nhân. Nhiều bệnh nhân Châu Á dương tính với HLA-B*1502 và điều trị bằng Trilental không bị SJS/TEN và bệnh nhân âm tính với HLA-B*1502 bất kì chủng tộc nào vẫn có thể bị SJS/TEN. Tương tự với các bệnh nhân dương tính HLA A*3101 và dùng Trileptal không bị SJS, TEN, DRESS, AGEP hoặc phát ban dát sẩn và các bệnh nhân âm tính HLA-A*3101 bất kì chủng tộc nào vẫn có thể bị các phản ứng phụ nặng trên da. Vai trò của các yếu tố tiềm năng khác trong sự phát triển và bệnh suất phản ứng phụ trên da này ví dụ như liều AED, sự tuân thủ, sử dụng đồng thời với các thuốc khác, các bệnh khác đi kèm và mức độ giám sát về da chưa được nghiên cứu.
Thông tin cho các chuyên gia y tế
Nếu kiểm tra sự hiện diện của gen đồng vị HLA-B*1502 được thực hiện, kiểu gen HLA-B*1502 phân giải cao được khuyến cáo. Thử nghiệm dương tính nếu một trong hai đồng vị HLA-B*1502 được phát hiện và âm tính nếu không phát hiện thấy gen đồng vị nào. Tương tự nếu kiểm tra sự hiện diện của gen đồng vị HLA-B*3101 được thực hiện, “kiểu gen HLA-B*3101” phân giải cao được khuyến cáo. Thử nghiệm dương tính nếu một trong hai đồng vị HLA-B*3101 được phát hiện và âm tính nếu không phát hiện thấy gen đồng vị nào.
Nguy cơ tăng nặng tình trạng bệnh động kinh
Nguy cơ tăng nặng bệnh được báo cáo khi dùng Trilental. Nguy cơ này được xem là đặc biệt ở trẻ em, nhưng cũng có thể xảy ra ở người lớn. Trong trường hợp tăng nặng, nên dừng sử dụng Trileptal.
Hạ natri máu
Có tới 2,7% số bệnh nhân dùng Trileptal có nồng độ natri trong huyết thanh dưới 125 mmol/lít, thường không có triệu chứng và không đòi hỏi liệu pháp điều trị. Kinh nghiệm từ các thử nghiệm lâm sàng cho thấy nồng độ natri-huyết thanh sẽ trở lại mức | bình thường sau khi giảm liều hoặc ngừng Trileptal hoặc khi bệnh nhân được điều trị thận trọng (ví dụ hạn chế dịch nhập).
Với bệnh nhân đã có bệnh thận từ trước, kèm theo thiếu hụt hàm lượng natri (như hội chứng tiết ADH không phù hợp) hoặc với bệnh nhân dùng phối hợp thuốc thải natri (ví dụ: thuốc lợi niệu, thuốc làm bài tiết không thích đáng ADH), thì phải định lượng nồng độ natri-huyết thanh trước khi khởi đầu dùng Trileptal. Sau đó, cũng cần xét nghiệm nồng độ natri-huyết thanh sau khoảng 2 tuần và tiếp đó là xét nghiệm hàng tháng trong 3 tháng điều trị đầu tiên, hoặc tùy thuộc vào yêu cầu của lâm sàng. Những yếu tố nguy cơ này đặc biệt cần tính đến với bệnh nhân cao tuổi.
Với bệnh nhân dùng Trileptal mà bắt đầu dùng thuốc làm hạ natri, thì cũng theo dõi đánh giá natri như đã nêu trên. Nói chung, khi gặp những triệu chứng lâm sàng về hạ natri-máu khi dùng Trileptal (xem phần PHẢN ỨNG BẤT LỢI), có thể cân nhắc để đo hàm lượng natri-huyết thanh. Những bệnh nhân khác có thể có nồng độ natri-huyết thanh được đánh giá như một phần của các nghiên cứu thường quy trong labố.
Mọi bệnh nhân có suy tim hoặc bệnh tim thứ phát cần kiểm tra đều đặn thể trọng để xác định xem có xảy ra tích lũy dịch hay không? Nếu gặp tích lũy dịch hoặc trạng thái tim xấu đi, cần đánh giá nồng độ natri-huyết thanh. Khi có hạ natri-máu, thì biện pháp quan trọng là hạn chế dùng nước. Vì oxcarbazepine trong trường hợp rất hiếm có thể làm suy yếu dẫn truyền tim, phải theo dõi cẩn thận những bệnh nhân nào đã có rối loạn dẫn truyền tim từ trước (ví dụ: block nhĩ-thất, loạn nhịp tim).
Suy giáp
Suy giáp là một phản ứng bất lợi rất hiếm của oxcarbazepine. Vì tầm quan trọng của hormon tuyến giáp với sự phát triển của trẻ sau sinh, nên đánh giá chức năng tuyến giáp trước khi bắt đầu điều trị với Trilental ở nhóm bệnh nhân trẻ em, đặc biệt ở trẻ từ hai tuổi trở xuống. Khuyến cáo theo dõi chức năng tuyến giáp khi điều trị với Trilental ở nhóm bệnh nhân trẻ em.
Chức năng gan
Rất hiếm gặp viêm gan, phần lớn các trường hợp qua khỏi dễ dàng. Nếu nghi có viêm gan, nên cân nhắc ngừng dùng Trileptal. Thận trọng khi điều-trị với bệnh nhân suy gan nặng (xem phần LIỀU DÙNG VÀ CÁCH DÙNG, ĐẶC TÍNH DƯỢC ĐỘNG HỌC và phần ĐẶC TÍNH DƯỢC LỰC HỌC).
Chức năng thận
Thận trọng khi dùng Trileptal cho bệnh nhân suy giảm chức năng thận (độ thanh thải creatinin nhỏ hơn 30mL/phút), đặc biệt khi dùng liều khởi đầu và khi tăng liều (xem phần LIỀU DÙNG VÀ CÁCH DÙNG, ĐẶC TÍNH DƯỢC ĐỘNG HỌC và phần ĐẶC TÍNH DƯỢC LỰC HỌC).
Tác dụng về huyết học
Đã có báo cáo trong trường hợp rất hiếm về chứng mất bạch cầu hạt, thiếu máu bất sản và giảm toàn thể huyết cầu ở những bệnh nhân được điều trị bằng Trilental trong nghiên cứu hậu mãi (xem phần PHẢN ỨNG BẤT LỢI). Tuy nhiên, do tỷ lệ mắc mới các tình trạng này rất thấp và các yếu tố n nhiễu (ví dụ như bệnh chính, thuốc dùng đồng thời), không thể xác định được quan hệ nhân quả. Cần xem xét ngừng dùng thuốc nếu có bất kỳ biểu hiện nào về suy tủy xương đáng kể.
Ý định và hành vi tự tử
Đã có báo cáo về hành vi và ý định tự tử ở những bệnh nhân điều trị các thuốc chống động kinh trong một số chỉ định. Một nghiên cứu tổng hợp của các thử nghiệm lâm sàng ngẫu nhiên, có đối chứng với giả dược của các thuốc chống động kinh cho thấy có sự tăng nhẹ nguy cơ về hành vi và ý định tự tử. Cơ chế của nguy cơ này chưa được biết đên. Do đó các bệnh nhân cần được theo dõi các dấu hiệu của hành vi và ý định tự tử và cần xem xét các biện pháp điều trị thích hợp, Các bệnh nhân (và người chăm sóc bệnh nhân) nên hỏi bác sỹ khi thấy dấu hiệu ý định hoặc hành vi tự tử.
Tương tác thuốc
Thuốc ngừa thai hormon
Bệnh nhân nữ ở tuổi sinh đẻ cần được cảnh báo là khi phối hợp Trileptal với các hormon ngừa thai có thể làm mất tác dụng ngừa thai (xem phần TUONG TAC THUOC và phân PHỤ NỮ CÓ THAI, CHO CON BÚ VÀ KHẢ NĂNG SINH SẢN). Khi dùng Trileptal, khuyến cáo nên sử dụng các biện pháp ngừa thai không phải hormon.
Rượu
Cần thận trọng khi dùng rượu với Trilental do có thể tăng tác dụng làm buồn ngủ.
Tác dụng khi ngừng dùng thuốc
Cũng như với mọi thuốc chống động kinh, cần ngừng Trilental dần dần theo từng mức độ, để giảm thiểu nguy cơ tăng tần số co giật.
Tóm tắt dữ liệu an toàn
Những phản ứng có hại hay gặp nhất gồm buồn ngủ, nhức đầu, choáng váng, nhìn đôi, buồn nôn, nôn, mệt mỏi, gặp ở > 10% bệnh nhân.
Trong các thử nghiệm lâm sàng, các biến cố bất lợi (AE) thường ở mức độ từ nhẹ tới trung bình, có tính chất thoáng qua và hay gặp hơn khi khởi đầu điều trị.
Phân tích biểu đồ tác dụng không mong muốn theo hệ cơ quan là dựa vào các hiện tượng có hại từ các thử nghiệm lâm sàng được đánh giá có liên quan tới Trileptal. Ngoài ra, các báo cáo có ý nghĩa lâm sàng về kinh nghiệm có hại từ các chương trình với bệnh nhân được xác định và kinh nghiệm khi đưa thuốc ra thị trường cũng được tính đến.
Bảng tóm tắt tổng hợp các phản ứng bất lợi từ các thử nghiệm lâm sàng
Các phản ứng bất lợi từ các thử nghiệm lâm sàng (Bảng 2) được liệt kê theo hệ thống phân loại cơ quan MedDRA. Trong mỗi hệ thống cơ quan, phản ứng bất lợi được xếp hạng theo tần suất, với phản ứng có tần suất cao nhất đứng trước. Trong mỗi nhóm tần suất, phản ứng bất lợi được xếp theo thứ tự giảm dần mức độ nghiêm trọng. Thêm vào đó, nhóm tần suất tương ứng được xếp theo qui ước sau (CIOMS III):
Rất thường gặp: (≥ 1/10); thường gặp: (≥ 1/100, < 1/10); Ít gặp: (≥ 1/1.000, < 1/100); hiếm gặp: (≥ 1/10.000, < 1/1.000); rất hiếm gặp: (< 1/10.000), bao gồm cả các báo cáo riêng lẻ.
Bảng 2 Các phản ứng bất lợi của thuốc
| Rối loạn máu và hệ bạch huyết | |
| Ít gặp | Giảm bạch cầu. |
| Rất hiếm gặp | Suy tủy xương, thiếu máu bất sản, mất bạch cầu hạt, giảm toàn thể huyết cầu, giảm tiểu cầu, giảm bạch cầu trung tính. |
| Rối loạn hệ miễn dịch | |
| Rất hiếm gặp | Phản ứng phản vệ, quá mẫn cảm (bao gồm quá mẫn cảm nhiều cơ quan) được đặc trưng bởi các biểu hiện như nổi ban, sốt. Các cơ quan hoặc hệ thống khác có thể bị ảnh hưởng như máu và hệ bạch huyết (ví dụ tăng bạch cầu ưa eosin, giảm tiểu cầu, giảm bạch cầu, bệnh hạch bạch huyết, lách to), gan (ví dụ: viêm gan, các xét nghiệm bất thường về chức năng gan), cơ và khớp (ví dụ: sưng khớp, đau cơ, đau khớp), hệ thần kinh (ví dụ: bệnh não-gan), thận (ví dụ: suy thận, viêm thận kẽ, protein niệu), phổi (ví dụ: phù phổi, hen, co thắt phế quản, bệnh phổi kẽ, khó thở), phù mạch. |
| Rối loạn nội tiết | |
| Thường gặp | Tăng cân. |
| Rất hiếm gặp | Suy giáp. |
| Rối loạn chuyển hóa và dinh dưỡng | |
| Thường gặp | Hạ natri máu. |
| Rất hiếm gặp | Hạ natri máu liên quan với các dấu hiệu và triệu chứng như co giật, bệnh não, giảm ý thức, lú lẫn, (xem thêm Rối loạn hệ thần kinh để rõ thêm các phản ứng bất lợi), suy giáp, rối loạn thị giác (ví dụ nhìn mờ), nôn, buồn nôn, thiếu hụt acid folic. |
| Rối loạn tâm thần | |
| Hay gặp | Kích động (ví dụ: căng thẳng thần kinh), cảm xúc không ổn định, tình trạng lú lẫn, trầm cảm, vô cảm |
| Rối loạn hệ thần kinh | |
| Rất thường gặp | Buồn ngủ, nhức đầu, chóng mặt. |
| Thường gặp | Mất điều hòa, run, rung giật nhãn cầu, rối loạn sự chú ý, mất trí nhớ. |
| Rối loạn mắt | |
| Rất thường gặp | Song thị. |
| Thường gặp | Nhìn mờ, rối loạn thị giác. |
| Rối loạn tại và mề đạo | |
| Thường gặp | Chóng mặt. |
| Rối loạn tim | |
| Rất hiếm gặp | Bloc nhĩ thất, loạn nhịp |
| Rối loạn mạch | |
| Rất hiếm gặp | Tăng huyết áp. |
| Rối loạn tiêu hóa | |
| Rất thường gặp | Nôn, buồn nôn. |
| Thường gặp | Tiêu chảy, đau bụng, táo bón. |
| Rất hiếm gặp | Viêm tụy và/hoặc tăng lipase và/hoặc tăng amylase. |
| Rối loạn gan mật | |
| Rất hiếm gặp | Viêm gan. |
| Rối loạn da và mô dưới da | |
| Thường gặp | Nổi ban, rụng lông tóc, mụn trứng cá |
| Ít gặp | Nổi mề đay. |
| Rất hiếm gặp | Hội chứng Stevens-Johnson, hoại tử biểu bì nhiễm độc (hội chứng Lyell), phù mạch, ban đỏ đa hình. |
| Rối loạn cơ xương, mô liên kết và xương | |
| Rất hiếm gặp | Lupus ban đỏ hệ thống. |
| Rối loạn toàn thân và tình trạng tại chỗ dùng thuốc | |
| Rất thường gặp | Mệt mỏi. |
| Thường gặp | Suy nhược. |
| Xét nghiệm | |
| Ít gặp | Tăng men gan, tăng phosphatase kiềm trong máu. |
| Rất hiếm gặp | Tăng amylase, tăng lipase. |
* Trong khi dùng Trileptal, rất hiếm gặp hạ natri-máu có ý nghĩa lâm sàng (natri < 125 mmol/lít). Thường gặp trong vòng 3 tháng đầu điều trị, mặc dù có những bệnh nhân bị hạ natri-huyết thanh < 125 mmol/lít lần đầu tiên sau hơn 1 năm khởi đầu điều trị (xem mục CẢNH BÁO VÀ THẬN TRỌNG).
Trong các thử nghiệm lâm sàng ở trẻ em từ 1 tháng tuổi tới dưới 4 tuổi, phản ứng có hại hay gặp nhất là buồn ngủ, gặp ở khoảng 11% bệnh nhân. Những phản ứng có hại với tần số > 1% và < 10% (thường gặp là: thất điều, kích ứng, nôn, ngủ lịm, mệt mỏi, rung giật nhãn cầu, run, giảm thèm ăn và tăng acid uric-máu.
Tác dụng không mong muốn ghi nhận từ các báo cáo tự phát và các trường hợp trong y văn (chưa biết tần suất)
Các tác dụng không mong muốn sau đã được ghi nhận từ kinh nghiệm hậu mãi của Trilental thông qua các báo cáo tự phát và báo cáo trong y văn. Do những tác dụng không mong muốn này được báo cáo tự nguyện từ nguồn bệnh có cỡ mẫu không xác định nên không thể ước lượng chính xác được tần suất, vì vậy mục này sẽ được xếp loại là chưa biết tần suất.
Những tác dụng không muốn được liệt kê dưới đây theo phân loại hệ cơ quan của MedDRA. Trong mỗi hệ cơ quan, ADRs được ghi nhận theo trình tự giảm dần về độ nghiêm trọng.
Rối loạn chuyển hóa và dinh dưỡng
Hội chứng tiết ADH không thích hợp, với dấu hiệu và triệu chứng như thờ ơ, buồn nôn, chóng mặt, giảm thẩm thấu huyết thanh (máu), nôn, nhức đầu, lú lẫn hoặc các dấu hiệu và triệu chứng thần kinh khác.
Rối loạn da và mô dưới da
Phát ban do thuốc với tăng bạch cầu eosin và các triệu chứng hệ thống (DRESS), ngoại ban mụn mủ toàn thân cấp tính (AGEP).
Chấn thương, ngộ độc và các biến chứng phẫu thuật
Té ngã.
Rối loạn hệ thần kinh
Rối loạn ngôn ngữ (bao gồm loạn vận ngôn), thường gặp hơn khi tăng liều Trileptal.
Rối loại hệ cơ xương và mô liên kết
Đã có báo cáo về tình trạng giảm mật độ khoáng ở xương, thiếu xương, loãng xương và gãy xương ở bệnh nhân điều trị lâu dài với Trileptal. Cơ chế oxcarbazepine ảnh hưởng đến hệ xương vẫn chưa được xác định.
Ức chế enzym
Oxcarbazepine được đánh giá ở các microsom gan người để xác định khả năng ức chế các enzyme cytochrome P450 chính chịu trách nhiệm đối với việc chuyển hóa các thuốc khác. Kết quả cho thấy rằng oxcarbazepine và sản phẩm chuyển hóa có hoạt tính dược lý của thuốc (dẫn xuất monohydroxy, MHD) ức chế CYP2C19. Vì vậy có thể có tương tác khi phối hợp liều cao Trileptal với các thuốc được chuyển hóa bởi CYP2C19 (ví dụ phenobarbital, phenytoin, xem dưới đây). Ở một số bệnh nhân được điều trị bằng Trileptal và các thuốc được chuyển hóa qua CYP2C19 có thể cần giảm liều của thuốc dùng phối hợp. Ở microsom gan người, oxcarbazepine và MHD có ít hoặc không có khả năng hoạt động như là các chất ức chế đối với các enzyme sau: CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1, CYP4A9 và CYP4A11.
Cảm ứng enzym
In vitro và in vivo oxcarbazepine và MHD gây cảm ứng cytochrome CYP3A4 và CYP3A5 chịu trách nhiệm trong việc chuyển hóa các chất đối kháng dihydropyridine calcium và các thuốc tránh thai đường uống, và thuốc chống động kinh (ví dụ carbamazepine) dẫn đến kết quả làm giảm nồng độ huyết tương của những thuốc này (xem dưới đây). Mức giảm về nồng độ trong huyết tương cũng quan sát được ở các thuốc khác được chuyển hóa chủ yếu bởi CYP3A4 và CYP3A5, ví dụ các thuốc ức chế miễn dịch (như ciclosporin).
In vitro, oxcarbazepine và MHD là những chất gây cảm ứng yếu enzym UDP ansferase và vì vậy in vivo không chắc những chất này có ảnh hưởng tới tác dụng của các thuốc được bài tiết chủ yếu bằng con đường liên hợp qua xúc tác của UDP-glucurony]-transferase (ví dụ: acid valproic, lamotrigine). Nhưng ngay cả khi 0xcarbazepine và MHD chỉ là chất gây cảm ứng yếu UDP-glucuronyl-transferase, thì cũng vẫn cần dùng liều cao hơn của các thuốc phối hợp với Trileptal mà lại được chuyển hóa qua CYP3A4 hoặc qua liên hợp (UDP-glucuronyl-transferase). Khi ngừng dùng Trileptal, cần giảm liều của thuốc phối hợp.
Những nghiên cứu về cảm ứng enzym trên tế bào gan người đã xác định là oxcarbazepine và MHD là những chất cảm ứng yếu của các isoenzym của phân họ CYP2B và CYP3A4. Chưa rõ tác dụng gây cảm ứng của oxcarbazepine/MHD lên các isoenzym CYP khác.
Các thuốc chống động kinh và các thuốc cảm ứng enzym
Những tương tác có khả năng xảy ra giữa Trileptal và các thuốc chống động kinh khác (AED) đã được đánh giá qua các nghiên cứu lâm sàng. Tác dụng của những tương tác này đối với diện tích dưới đường cong nồng độ (AUCs) trung bình và nồng độ tối thiểu (Cmin) được tổng kết ở bảng 1 dưới đây:
Bảng 1: Tóm tắt về tương tác giữa các thuốc chống động kinh với Trilental
|
Thuốc chống động kinh Phối hợp |
Ảnh hưởng của Trileptal tới các thuốc chống động chống động kinh Nồng độ |
Ảnh hưởng của các thuốc tới MHD Nồng độ |
|
Clobazam Felbamate Phenobarbital Valproic acid |
Giảm 0-22% Chưa nghiên cứu Chưa nghiên cứu Tăng 14-15% Tăng 0-40% Không ảnh hưởng |
Giảm 40% Không ảnh hưởng Không ảnh hưởng Giảm 30-31% Giảm 29-35% Giảm 0-18% |
| Lamotrigine | Không ảnh hưởng | Không ảnh hưởng |
In vivo, nồng độ huyết tương của phenytoin tăng tới 40% khi Trileptal được cho dùng với liều 1.200 mg/ngày. Vì vậy, khi dùng liều Trileptal cao hơn 1.200 mg/ngày trong quá trình điều trị bổ trợ, cần giảm liều phenytoin (xem phần LIỀU DÙNG VÀ CÁCH DÙNG). Tuy nhiên, sự tăng nồng độ phenobarbital là thấp (15%) khi được dùng cùng với Trileptal.
Những chất gây cảm ứng mạnh các enzyme cytochrome P450 và/ hoặc enzym UDP glucuronyl-transferase (ví dụ: rifampicin, carbamazepine, phenytoin và phenobarbital) đã được thấy là làm giảm nồng độ huyết tương của MHD (29-49%).
Chưa quan sát thấy sự tự cảm ứng đối với Trileptal.
Các thuốc tránh thai hormon
Trileptal được thấy là có tác dụng đối với hai thành phần, ethinylestradiol (EE) và levonorgestrel (LNG), trong một thuốc tránh thai dùng đường uống. Các giá trị trung bình AUC của EE giảm 48-52% và của LNG giảm 32-52%. Những nghiên cứu với các thuốc tránh thai đường uống hoặc cấy khác chưa được tiến hành. Vì vậy, việc dùng đồng thời Trileptal với các thuốc tránh thai hormon có thể làm những thuốc tránh thai này giảm hiệu lực (xem phần CẢNH BÁO VÀ THẬN TRỌNG và phần PHỤ NỮ CÓ THAI, CHO CON BÚ VÀ KHẢ NĂNG SINH SẢN).
Các thuốc đối kháng Calcium
Sau khi dùng đồng thời nhiều lần với Trileptal, các giá trị AUC của felodipine bị giảm 28%. Tuy nhiên, nồng độ huyết tương vẫn giữ ở mức được khuyến cáo cho điều trị.
Mặt khác, verapamil làm giảm 20% nồng độ huyết tương của MHD. Sự giảm nồng độ huyết tương này của MHD không được xem là có liên quan về lâm sàng.
Các tương tác thuốc khác
Cimetidine, erythromycine và dextropropoxyphene không ảnh hưởng tới dược động học của MHD, còn viloxazine chỉ gây những thay đổi nhỏ đối với nồng độ huyết tương của MHD (cao hơn khoảng 10% nếu dùng đồng thời nhiều lần). Những kết quả với warfarin cho thấy không có chứng cớ nào về tương tác thuốc khi dùng đồng thời một lần hoặc nhiều lần với Trileptal.
Do không có các nghiên cứu về tính tương kỵ của thuốc, không nên trộn lẫn thuốc này với các thuốc khác.
Phụ nữ có thai
Tóm tắt nguy cơ
Con của các bà mẹ động kinh dễ bị rối loạn phát triển, bao gồm dị tật. Dùng oxcarbazepine trong thai kỳ cho thấy thuốc này có thể gây dị tật nghiêm trọng khi sinh, tuy dữ liệu về số lượng còn hạn chế. Các dị tật bẩm sinh thường gặp nhất quan sát thấy khi điều trị với oxcarbazepine là khiếm khuyết vách ngăn thất trái, khiếm khuyết vách ngăn nhĩ thất, hở hàm ếch với sứt môi, hội chứng Down, loạn sản xương hông (một bên và hai bên), xơ cứng củ và dị tật bẩm sinh tai. Dựa trên dữ liệu trong một danh sách đăng ký mang thai ở Bắc Mỹ, tỷ lệ dị tật bẩm sinh nghiêm trọng, được định nghĩa là các bất thường cấu trúc cần phẫu thuật, dùng thuốc hoặc thẩm mỹ, được chẩn đoán trong vòng 12 tuần sau sinh ở các bà mẹ dùng oxcarbazepine ở ba tháng đầu thai kỳ là 2% (95% khoảng tin cậy: 0,6 đến 5,1%). Khi so sánh với những phụ nữ mang thai không dùng bất kỳ một thuốc chống động kinh nào, nguy cơ tương đối (RR) bị dị tật bẩm sinh phụ nữ mang thai dùng oxcarbazepine là 1,6 (95% khoảng tin cậy: 0,46 đến 5,7).
Cân nhắc trên lâm sàng
Cần cân nhắc các trường hợp sau đây:
Theo dõi và phòng ngừa
Thuốc chống động kinh có thể gây thiếu hụt acid folic, là nguyên nhân có thể gây bất thường cho thai. Trước và trong thai kỳ, khuyến cáo nên bổ sung acid folic cho người mang thai.
Do những thay đổi về sinh lý trong quá trình mang thai, nồng độ trong huyết tương của chất chuyển hóa có hoạt tính của oxcarbazepine, dẫn xuất 10-monohydroxy (MHD) có thể giảm dần trong suốt thai kỳ. Được khuyến cáo rằng đáp ứng lâm sàng nên được theo dõi cẩn thận ở những phụ nữ điều trị bằng Trilental trong khi mang thai và việc xác định sự thay đổi của nồng độ MHD huyết tương nên được xem xét để đảm bảo rằng việc kiểm soát cơn động kinh một cách thỏa đáng được duy trì trong suốt thai kỳ (xem phần LIEU DUNG VÀ CÁCH DÙNG, ĐẶC TÍNH DƯỢC ĐỘNG HỌC và phần ĐẠC TÍNH DƯỢC LỰC HỌC). Nồng độ MHD huyết tương sau sinh có thể cũng cần được xem xét theo dõi đặc biệt trong trường hợp việc sử dụng thuốc tăng lên trong khi mang thai.
Ở trẻ mới sinh
Đã có báo cáo về rối loạn chảy máu ở trẻ sơ sinh do mẹ dùng thuốc chống động kinh. Để thận trọng, nên có biện pháp phòng ngừa bằng cách cho mẹ dùng vitamin K trong một số tuần cuối của thai kỳ và cả cho trẻ sơ sinh.
Oxcarbazepine và chất chuyển hóa có hoạt tính (là MHD) qua được hàng rào nhau thai. Nồng độ MHD trong huyết tương của trẻ sơ sinh và của mẹ là tương đương trong một trường hợp.
Dữ liệu trên động vật
Các nghiên cứu chuẩn về độc tính sinh sản ở loài gặm nhấm và thỏ cho thấy thuốc có tác dụng làm tăng tỉ lệ chết của phôi và một phần làm chậm phát triển thai và/hoặc chậm lớn ở con sau khi sinh nếu dùng liều độc cho vật mẹ. Ghi nhận tăng dị dạng ở thai chuột cống ở 1 trong 8 nghiên cứu về độc tính phôi thai, được tiến hành với oxcarbazepine hoặc MHD khi dùng với liều cũng gây độc cho mẹ. Bằng chứng từ tất cả các nghiên cứu trên động vật cho thấy oxcarbazepine có tiềm năng nhỏ gây quái thai ở những liều dùng cho người. Tuy nhiên các nghiên cứu trên động vật không đủ để loại trừ ảnh hưởng gây quái thai của oxcarbazepine.
Phụ nữ cho con bú
Tóm tắt nguy cơ
Oxacarbazepine và chất chuyển hóa có hoạt tính của nó (MHD) được bài tiết vào sữa mẹ. Nồng độ thuộc trong sữa mẹ bằng 50% nồng độ trong huyết tương được tìm thấy đối với cả hai chất. Chưa rõ các ảnh hưởng đối với trẻ phơi nhiễm Trilental theo con đường này. Vì vậy, không nên dùng Trilental trong thời gian cho con bú.
Khả năng sinh sản
Tránh thai
Khuyến cáo phụ nữ có khả năng mang thai sử dụng biện pháp tránh thai có hiệu quả cao (tốt nhất là không có hormon, ví dụ dụng cụ cấy trong tử cung) trong khi điều trị bằng Trilental. Trileptal có thể dẫn đến mất hiệu quả điều trị của các thuốc tránh thai đường uống chứa ethinylestradiol (EE) và levonorgestrel (LNG) (xem CẢNH BÁO VÀ THẬN TRỌNG và TƯƠNG TÁC THUỐC).
Vô sinh
Không có dữ liệu trên người về khả năng sinh sản.
Ở chuột, khả năng sinh sản ở cả hai giới đều không bị ảnh hưởng bởi oxcarbazepine hoặc MHD ở liều uống tương ứng lên đến 150 mg và 450 mg/kg/ngày. Tuy nhiên, gián đoạn chu kỳ sinh sản, giảm số lượng thể vàng, cả cấy và phối sống đã quan sát thấy trên động vật cái ở liều cao nhất của MHD.
Các phản ứng bất lợi như chóng mặt, buồn ngủ, mất điều hòa, nhìn đôi, nhìn mờ, rối loạn thị giác, giảm natri huyết và giảm ý thức đã được báo cáo với Trileptal (danh sách đầy đủ các phản ứng bất lợi xem phần PHẢN ỨNG BẤT LỢI), đặc biệt ở giai đoạn bắt đầu điều trị, hoặc giai đoạn chuyển đổi khi chỉnh liều (thường gặp hơn trong giai đoạn tăng liều). Vì vậy cần cảnh báo bệnh nhân khi lái xe và vận hành máy móc.
Một số trường hợp cá biệt về quá liều đã được báo cáo. Liều tối đa đã được dùng là khoảng 48.000 mg.
Dấu hiệu và triệu chứng
Tình trạng mất cân bằng dịch và điện giải: hạ natri máu.
Rối loạn thị giác: song thị, co đồng tử, mờ mắt. Rối loạn hệ tiêu hóa: buồn nôn, nôn, tăng vận động dạ dày.
Rối loạn toàn thân và tình trạng tại chỗ dùng thuốc: mệt mỏi.
Xét nghiệm: giảm tần số hô hấp, kéo dài khoảng QT.
Rối loạn hệ thần kinh trung ương: uể oải và buồn ngủ, chóng mặt, rung giật nhãn cầu, mất điều hòa, run, rối loạn phối hợp (bất thường phối hợp), co giật, đau đầu, hôn mê, mất ý thức, rối loạn vận động.
Rối loạn tâm thần: gây hấn, kích động, tình trạng lú lẫn.
Rối loạn mạch: hạ huyết áp.
Rối loạn hô hấp, ngực và trung thất: khó thở
Xử trí
Không có thuốc giải độc đặc hiệu. Việc điều trị triệu chứng và hỗ trợ nên được tiến hành thích hợp. Việc loại bỏ thuốc bằng rửa dạ dày và/hoặc bất hoạt thuốc bằng than hoạt nên được xem xét.
HẠN DÙNG: 36 tháng kể từ ngày sản xuất.
ĐIỀU KIỆN BẢO QUẢN: Bảo quản dưới 30°C. Bảo quản thuốc trong bao bì còn nguyên.
CƠ SỞ SẢN XUẤT Novartis Farma S.p.A. Via Provinciale Schito, 131 80058 Torre Annunziata (NA), Ý.
Nhóm dược lý: Thuốc chống động kinh.
Mã ATC: N03A F02.
Cơ chế tác dụng (MMA)
Hoạt tính dược học của Trileptal (hay oxcarbazepine) chủ yếu được phát huy qua sản phẩm chuyển hóa (MHD) của oxcarbazepine (xem “DƯỢC ĐỘNG HỌC” – Biến đổi sinh học/chuyển hóa). Cơ chế hoạt động của oxcarbazepine và MHD được cho là chủ yếu dựa trên việc chọn các kênh natri nhạy cảm điện thế, do đó làm ổn định màng thần kinh bị tăng hưng phấn, ức chế sự kích thích lặp lại ở tế bào thần kinh và giảm bớt sự lan tỏa của các xung động qua synap thần kinh. Ngoài ra, độ dẫn kali tăng và sự điều biến của các kênh calci hoạt hóa điện thế cao cũng có thể góp phần vào các tác dụng chống co giật của thuốc. Không có tương tác thuốc quan trọng nào với các vị trí thụ thể điều hòa thần kinh hoặc chất dẫn truyền thần kinh.
Đặc tính được lực học
Oxcarbazepine và sản phẩm chuyển hóa có hoạt tính của nó (MHD) đều có khả năng chống co giật mạnh và hiệu quả trên súc vật. Chúng bảo vệ các loài gặm nhấm chống được co cứng-co giật toàn thể, ở một mức độ thấp hơn, các cơn động kinh rung giật, và làm mất hoặc giảm tần suất của các cơn động kinh cục bộ thường xuyên mãn tính trên khỉ Rhesus được cấy những mảnh aluminium. Không có sự dung nạp (ví dụ: suy giảm hoạt động chống co giật) đối với các cơn động kinh co cứng-co giật được quan sát thấy trên chuột nhắt và chuột cống được điều trị hàng ngày trong 5 ngày hoặc trong 4 tuần bằng oxcarbazepine hoặc MHD.
Hấp thu
Sau khi uống viên nén Trileptal, oxcarbazepine được hấp thu hoàn toàn và được chuyển hóa phần lớn thành sản phẩm chuyển hóa có hoạt tính dược lý (dẫn xuất 10 monohydroxy, MHD).
Sau khi dùng liều duy nhất 600 mg viên nén Trilental trên những người nam tình nguyện khỏe mạnh nhịn ăn, giá trị Cmax trung bình của MHD là 34 micromol/L, với giá trị tmax trung bình tương ứng là 4,5 giờ.
Dạng viên nén và hỗn dịch uống oxcarbazepine là tương đương sinh học vì đường cong nồng độ trung bình ở liều đơn và trạng thái ổn định, Cmax và AỤC trong khoảng 0,85 đến 1,86 (90% khoảng tin cậy).
Trong một nghiên cứu cân bằng khối lượng trên người, chỉ có 2% tổng số phóng xạ trong huyết tương là do oxcarbazepine ở dạng không đổi, khoảng 70% là do MHD, và phần còn lại là do các sản phẩm chuyển hóa thứ cấp nhanh chóng bị đào thải.
Thức ăn không ảnh hưởng đến tỷ lệ và khả năng hấp thu oxcarbazepine; do đó Trilental có thể dùng kèm hoặc không kèm với thức ăn (xem phần LIÊU DÙNG VÀ CÁCH DÙNG).
Phân bố
Thể tích phân bố biểu kiến của MHD là 49 lít.
Khoảng 40% MHD gắn với protein huyết thanh, chủ yếu với albumin. Sự gắn kết này không phụ thuộc vào nồng độ huyết thanh trong phạm vi liên quan đến việc điều trị. Oxcarbazepine và MHD không gắn với alpha-1-acid glycoprotein.
Biến đổi sinh học/chuyển hóa
Oxcarbazepine nhanh chóng được các enzyme cytosolic ở gan chuyển hóa thành MHD, chất này chịu trách nhiệm chính đối với các tác dụng dược lý của Trileptal. MHD tiếp tục được chuyển hóa bởi sự kết hợp với acid glucuronic. Một lượng nhỏ (4% liều dùng) được oxy hóa thành sản phẩm chuyển hóa không có hoạt tính (dẫn xuất 10, 11 dihydroxy, DHD).
Thải trừ
Oxcarbazepine được thải trừ khỏi cơ thể phần lớn ở dạng các sản phẩm chuyển hóa và được bài tiết chủ yếu qua thận. Hơn 95% liều dùng thải ra nước tiểu, trong đó dưới 1% dạng oxcarbazepine không đổi. Lượng bài tiết qua phần chiếm dưới 4% liều dùng. Khoảng 80% liều được bài tiết qua nước tiểu dưới dạng hoặc là MHD kết hợp glucuronide (49%) hoặc là MHD không đổi (27%), còn lượng DHD không có hoạt tính chiếm khoảng 3% và các chất kết hợp của oxcarbazepine chiếm 13% liều dùng. Oxcarbazepine nhanh chóng được loại trừ khỏi huyết tương với thời gian bán hủy khoảng 1,3-2,3 giờ. Trái lại, thời gian bán hủy biểu kiến trong huyết tương của MHD là 9,3±1,8 giờ.
Tuyến tính/không tuyến tính
Nồng độ MHD trong huyết tương ở trạng thái bền vững đạt được sau 2-3 ngày trên bệnh nhân khi Trileptal được dùng chia làm hai lần trong ngày. Ở trạng thái bền vững, dược động học của MHD có tính chất tuyến tính và cho thấy tính cân đối liều ở mức 300 2.400 mg/ngày.
Đối tượng đặc biệt
Suy gan
Dược động học và sự chuyển hóa oxcarbazepine và MHD đã được đánh giá trên những người tình nguyện khỏe mạnh và những đối tượng có suy gan sau khi uống liều duy nhất 900 mg. Suy gan nhẹ và vừa không ảnh hưởng tới dược động học của oxcarbazepine và MHD. Trilental chưa được nghiên cứu trên bệnh nhân suy gan nặng.
Suy thận
Có một mối liên hệ tuyến tính giữa hệ số thanh thải creatinine và hệ số thanh thải qua thận của MHD. Khi Trilental được cho dùng liều duy nhất 300 mg trên bệnh nhân suy thận (hệ số thanh thải creatinine < 30 mL/phút), thời gian bán hủy của MHD bị kéo dài 19 giờ với một mức tương ứng tăng gấp đôi trên diện tích dưới đường cong nồng độ (AUC).
Trẻ em
Độ thanh lọc của MHD được điều chỉnh theo thể trọng sẽ giảm khi tuổi tác và thể trọng tăng lên tiếp cận với tuổi và thể trọng của người lớn. Vì vậy, thấy độ thanh lọc trung bình của MHD đã được điều chỉnh theo thể trọng ở trẻ em (từ 1 tháng tuổi tới dưới 4 tuổi) sẽ chiếm 93% cao hơn độ thanh lọc ở người lớn. Cũng do đó, sự phơi nhiễm của MHD trong cơ thể các trẻ em này được thấy chỉ là khoảng một nửa so với sự phơi nhiễm của MHD ở người lớn, khi cũng dùng liều như nhau được điều chỉnh theo thể trọng. Độ thanh lọc trung bình của MHD đã được điều chỉnh theo thể trọng ở trẻ em (từ 4 tới 12 tuổi) sẽ cao hơn 43% so với độ thanh lọc trung bình ở người lớn. Vì vậy, sự phơi nhiễm của MHD trong cơ thể của các trẻ em này chỉ là 2/3 so với sự phơi nhiễm ở người lớn, khi cùng dùng liều như nhau đã được điều chỉnh theo thể trọng. Một khi có tăng thể trọng, thì với bệnh nhân – 13 tuổi, thấy độ thanh lọc của MHD được điều chỉnh theo thể trọng, được đánh giá là đạt độ thanh lọc MHD ở người lớn.
Phụ nữ có thai
Do những thay đổi về sinh lý trong quá trình mang thai, nồng độ MHD huyết tương có thể giảm dần trong suốt thai kỳ (xem phần LIỀU DÙNG VÀ CÁCH DÙNG, PHỤ NỮ CÓ THAI, CHO CON BÚ VÀ KHẢ NĂNG SINH SẢN).
Người già
Sau khi dùng liều duy nhất (300 mg) và nhiều lần (600 mg/ngày) Trileptal trên những người già tình nguyện (60-82 tuổi), nồng độ huyết tương tối đa và các giá trị AUC của MHD cao hơn từ 30-60% so với những người tình nguyện trẻ hơn (18-32 tuổi). Việc so sánh hệ số thanh thải giữa người trẻ và người già cho thấy sự khác nhau này là do sự suy giảm liên quan đến tuổi tác đối với hệ số thanh thải creatinine. Không cần phải có khuyến cáo đặc biệt nào về liều vì liều điều trị được điều chỉnh theo từng cá thể.
Giới
Không có sự khác biệt nào về dược động học liên quan đến giới được thấy ở trẻ em, người lớn hoặc người già.
Các nghiên cứu về đơn trị liệu với Trileptal
Hiệu quả của Trileptal trong đơn trị liệu đã được chứng minh qua 4 nghiên cứu đa trung tâm ngẫu nhiên mù đôi có đối chứng được thực hiện trên dân sổ chủ yếu là người trưởng thành. Hai nghiên cứu đối chứng Trileptal với giả dược, và hai nghiên cứu sử dụng thiết kế rút ngẫu nhiên để so sánh Trilental ở liều cao (2.400 mg) và liều thấp (300 mg) sau khi thay thế Trilental 2.400 mg/ngày cho tối thiểu một thuốc trị động kinh khác (AEDs). Tất cả các liều được cho theo chế độ 2 lần/ngày. Nghiên cứu thứ năm là một nghiên cứu đa trung tâm, ngẫu nhiên, được làm mù, có đối chứng, thực hiện trên dân số trẻ em, đã không thể chứng minh khác biệt có ý nghĩa lâm sàng giữa các nhóm điều trị với Trilental liều thấp và cao.
Một nghiên cứu đối chứng với giả dược được thực hiện trên 100 bệnh nhân (từ 11 đến 62 tuổi) bị động kinh cục bộ dai dẳng đã hoàn thành đánh giá nội trú cho phẫu thuật động kinh. Bệnh nhân được ngưng tất cả các thuốc chống động kinh và cần phải trải qua từ 2 đến 10 cơn động kinh cục bộ trong vòng 48 giờ trước khi tiến hành ngẫu nhiên hóa. Bệnh nhân được ngẫu nhiên thành các nhóm điều trị hoặc giả dược hoặc Trilental 1.500 mg/ngày vào Ngày 1 và liều 2.400 mg/ngày vào 9 ngày tiếp theo, hoặc cho đến khi xuất hiện 1 trong 3 tiêu chí ngùng điều trị theo nghiên cứu sau: 1) Xuất hiện cơm động kinh cục bộ lần thứ tư sau ngày 1; 2) xuất hiện 2 cơn động kinh toàn thể thứ phát mà chưa từng xảy ra trong vòng 1 năm trước khi ngẫu nhiên hóa; hoặc 3) xuất hiện các cơn động kinh liên tiếp hoặc trạng thái động kinh. Đánh giá hiệu quả chính là so sánh thời gian đạt được tiêu chí ngừng điều trị theo nghiên cứu giữa các nhóm. Kết quả là khác biệt có ý nghĩa thống kê nghiêng về Trileptal (xem hình 1) với p=0,0001.
Hình 1 Ước tính Kaplan-Meier về tỷ lệ gặp tiêu chí ngừng điều trị theo nghiên cứu theo nhóm điều trị

Nghiên cứu đối chứng giả dược thứ hai được thực hiện trên 67 bệnh nhân không được điều trị (từ 8 đến 69 tuổi) mới được chẩn đoán và chỉ mới khởi phát động kinh cục bộ gần đây. Bệnh nhân được chia ngẫu nhiên vào các nhóm điều trị giả dược hoặc Trileptal, khởi đầu ở 300 mg 2 lần/ngày và chuẩn độ liều đến 1.200 mg/ngày (chia thành 2 600 mg mỗi ngày) trong vòng 6 ngày, sau đó điều trị duy trì trong 84 ngày. Đánh giá hiệu quả chính là so sánh thời gian dẫn đến cơn động kinh đầu tiên. Khác biệt giữa 2 nhóm điều trị là có ý nghĩa thống kê và nghiêng về Trileptal (xem hình 2) với p=0,046.
Hình 2 Ước tính Kapla-Meier về tỷ lệ gặp cơn động kinh đầu tiên theo nhóm điều trị

Nghiên cứu lâm sàng thứ ba dùng đơn trị liệu Trilptal liều 2.400 mg/ngày thay cho carbamazepine trên 143 bệnh nhân từ 12 đến 65 tuổi có động kinh cục bộ không kiểm soát tốt bằng carbamazepine (CBZ) đơn trị liệu ở liều ổn định từ 800 đến 1.600 mg/ngày, và duy trì liều Trilental trong 56 ngày (giai đoạn ban đầu). Những bệnh nhân có thể tăng đến liều 2.400 mg/ngày đồng thời trong quá trình giảm dần liều carbamazepine được ngẫu nhiên hóa vào nhóm điều trị Trileptal 300 mg/ngày hoặc Trilental 2.400 mg/ngày. Bệnh nhân được quan sát trong 126 ngày hoặc cho đến khi xuất hiện 1 trong 4 tiêu chí ngừng điều trị theo nghiên cứu sau: 1) tăng gấp đôi tần suất động kinh đo lường trong 28 ngày so với giai đoạn ban đầu; 2) tăng gấp đôi tần suất động kinh cao nhất đo lường trong 2 ngày liên tiếp so với giai đoạn ban đầu; 3) xuất hiện 1 cơn động kinh toàn thể hóa nếu chưa từng có trong giai đoạn ban đầu; hoặc 4) cơn động kinh toàn thể hóa kéo dài. Đánh giá hiệu quả chính là so sánh thời gian đạt được tiêu chí ngừng điều trị theo nghiên cứu giữa các nhóm. Khác biệt giữa 2 đường biểu diễn là có ý nghĩa thống kê và nghiêng về nhóm điều trị với Trileptal 2.400 mg/ngày (xem hình 3), với p=0,0001.
Hình 3 Ước tính Kaplan-Meier về tỷ lệ gặp tiêu chí ngừng điều trị theo nghiên cứu theo nhóm điều trị

Một nghiên cứu thay thế đơn trị liệu khác được thực hiện trên 87 bệnh nhân từ 11 đến 66 tuổi có động kinh không được kiểm soát tốt bằng một hoặc hai thuốc chống động kinh. Bệnh nhân được ngẫu nhiên hóa vào các nhóm điều trị Trilental 2.400 mg/ngày hoặc 300 mg/ngày trong khi điều trị chống động kinh cơ bản của họ được loại bỏ dần dần trong vòng 6 tuần điều trị mù đôi. Điều trị mù đôi tiếp tục thêm 84 ngày kế tiếp (tổng thời gian điều trị mù đôi là 126 ngày) hoặc cho đến khi xuất hiện 1 trong 4 tiêu chí ngừng điều trị theo nghiên cứu như trong nghiên cứu kể trên. Đánh giá hiệu quả chính là so sánh tỉ lệ bệnh nhân đạt tiêu chí ngừng điều trị theo nghiên cứu giữa các nhóm. Kết quả khác biệt có ý nghĩa thống kê nghiêng về nhóm điều trị với Trilental 2.400 mg/ngày (14/34; 41,2%) so với nhóm Trileptal 300 mg/ngày (4245; 93,3%) với p<0,0001. Thời gian đến khi đạt được tiêu chí ngừng điều trị theo nghiên cứu cũng khác biệt có ý nghĩa thống kê và thiên về nhóm điều trị Trileptal 2.400 mg/ngày (xem hình 4) với p=0,0001.
Hình 4 Ước tính Kaplan-Meier về tỷ lệ gặp tiêu chí ngừng điều trị theo nghiên cứu theo nhóm điều trị

Một nghiên cứu đơn trị liệu được thực hiện trên 92 bệnh nhi từ 1 tháng đến 16 tuổi có động kinh cục bộ không được kiểm soát tốt hoặc mới khởi phát bệnh động kinh cục bộ. Bệnh nhân được nhập viện và ngẫu nhiên hóa vào nhóm Trileptal 10 mg/kg/ngày hoặc chuẩn độ liều đến 40-60 mg/kg/ngày trong vòng 3 ngày trong khi loại bỏ điều trị động kinh trước đó vào ngày thứ hai. Cơn động kinh được ghi nhận bằng giám sát EEG hình ảnh liên tục từ ngày 3 đến ngày 5. Bệnh nhân kết thúc 5 ngày điều trị hoặc đạt 1 trong 2 tiêu chí ngừng điều trị theo nghiên cứu sau: 1) 3 cơn động kinh quy định chuyên biệt của nghiên cứu (tức là cơn động kinh thể hiện trên điện não đồ và tương quan với hành vi); hoặc 2) cơn động kinh quy định chuyên biệt trong nghiên cứu kéo dài. Đánh giá hiệu quả chính là so sánh thời gian đến khi đạt tiêu chí ngưng điều trị theo nghiên cứu giữa các nhóm điều trị cho thấy khác biệt giữa các đường biểu diễn không có giá trị thống kê (p=0,904). Đa số bệnh nhân ở cả 2 nhóm điều trị hoàn thành 5 ngày nghiên cửu mà không đạt tiêu chí ngừng điều trị theo nghiên cứu.
Mặc dù nghiên cứu này không chứng minh được hiệu quả của oxcarbazepine trong đơn trị liệu cho bệnh nhi, có nhiều yếu tố về thiết kế bao gồm thời gian điều trị và đánh giá ngắn, không sử dụng giả dược thật khiến cho kết quả không thể diễn giải được. Vì lý do này, kết quả nghiên cứu không phủ quyết kết luận rằng oxcarbazepine là đơn trị liệu hiện quả cho trẻ em từ 4 tuổi trở lên, dựa trên phân tích dược động học/dược lực học.
Các nghiên cứu về Trileptal trong điều trị phối hợp
Hiệu quả của Trilental trong điều trị phối hợp trên động kinh cục bộ được hình thành qua 2 nghiên cứu đa trung tâm, ngẫu nhiên, mù đôi, đối chứng với giả dược, trong đó một nghiên cứu thực hiện trên 692 bệnh nhân từ 15 đến 66 tuổi và nghiên cứu còn lại thực hiện trên 264 bệnh nhi từ 3 đến 17 tuổi, và qua 1 nghiên cứu đa trung tâm, được làm mù, ngẫu nhiên, phân tầng theo tuổi, nhóm song song so sánh 2 liều oxcarbazepine trên 18 bệnh nhi từ 1 tháng đến dưới 4 tuổi.
Bệnh nhân trong 2 nghiên cứu đối chứng với giả dược được dùng 1 đến 3 thuốc đông thời điều trị động kinh. Ở cả 2 nghiên cứu, bệnh nhân được ổn định ở liều tối ưu của các thuốc đồng thời điều trị động kinh trong 8 tuần giai đoạn ban đầu. Những bệnh nhân có ít nhất 8 cơn động kinh cục bộ (tối thiểu 1 – 4 cơn mỗi tháng) trong giai đoạn ban đầu sẽ được ngẫu nhiên hóa vào nhóm giả dược hoặc nhóm điều trị với Trilental ở một liều xác định thêm vào với thuốc đồng thời điều trị động kinh.
Trong các nghiên cứu này, liều dùng được tăng dần trong vòng 2 tuần cho đến khi đạt tới liều mong muốn hoặc có tình trạng không dung nạp không cho phép tiếp tục tăng liều. Bệnh nhân sau đó bước vào giai đoạn duy trì kéo dài 14 tuần (với bệnh nhi) hoặc 24 tuần (với người lớn).
Trong nghiên cứu trên người lớn, bệnh nhân được nhận các liều cố định 600, 1.200 hoặc 2.400 mg/ngày. Trong nghiên cứu trên bệnh nhi, bệnh nhân được nhận liều duy trì trong khoảng 30-46 mg/kg/ngày, tùy vào cân nặng ban đầu. Đánh giá hiệu quả chính ở cả 2 nghiên cứu là so sánh tỷ lệ phần trăm thay đổi về tần suất cơn động kinh cục bộ trong giai đoạn điều trị mù đôi so với giai đoạn ban đầu giữa các nhóm điều trị. So sánh này cho thấy khác biệt có ý nghĩa lâm sàng nghiêng về Trileptal ở tất cả các liều thử nghiệm trong cả 2 nghiên cứu (p=0,0001 cho tất cả các liều ở cả 2 nghiên cứu). Số lượng bệnh nhân ngẫu nhiên hóa vào mỗi liều, trung vị tỷ lệ động kinh ở giai đoạn ban đầu, và trung vị của tỷ lệ phần trăm giảm đi trong mỗi nhóm được thể hiện trong Bảng 3. Một điều quan trọng cần lưu ý là ở nhóm điều trị liệu cao ở người lớn, hơn 65% bệnh nhân ngừng điều trị vì biến cố bất lợi, chỉ có 46 bệnh nhân (27%) hoàn thành nghiên cứu 28 tuần (xem phần PHẢN ỨNG BẤT LỢI CỦA THUỐC), điều này không được quan sát thấy trong các nghiên cứu về đơn trị liệu.
Bảng 3 Tóm tắt về tỷ lệ phần trăm thay đổi động kinh cục bộ từ giai đoạn ban đầu cho các nghiên cứu điều trị phối hợp có đối chứng với giả dược

Các phân tích phân nhóm về hiệu quả chống động kinh của Trilental theo giới tính trong những nghiên cứu này cho thấy không có khác biệt quan trọng trong đáp ứng giữa nam và nữ. Do có rất ít bệnh nhân trên 65 tuổi trong các nghiên cứu có đối chứng, tác dụng của thuốc đối với người lớn tuổi chưa được đánh giá đầy đủ.
Nghiên cứu thứ 3 về điều trị phối hợp thu trên 128 bệnh nhi từ 1 tháng đến dưới 4 tuổi có động kinh cục bộ không được kiểm soát đầy đủ bằng 1- 2 thuốc chống động kinh dùng đồng thời. Các bệnh nhân có ít nhất 2 cơn động kinh trong nghiên cứu (tức là cơn động kinh thể hiện trên điện não đồ và tương quan với hành vi trong giai đoạn 72 giờ ban đầu được phân ngẫu nhiên vào nhóm điều trị với Trileptal 10 mg/kg/ngày hoặc chuẩn độ liều đến 60 mg/kg/ngày trong vòng 26 ngày. Bệnh nhân được duy trì ở liều mục tiêu trong 3 ngày và các cơn động kinh được ghi nhận bằng giám sát EEG hình ảnh liên tục trong vòng 72 giờ cuối của giai đoạn duy trì. Đánh giá hiệu quả chính trong nghiên cứu này là so sánh sự thay đổi về tần suất động kinh trong 24 giờ so với tỷ lệ động kinh ở giai đoạn ban đầu giữa các nhóm điều trị. Trong tổng số bệnh nhân được thu nhận, so sánh này là có ý nghĩa lâm sàng thiên về Trilental 60 mg/kg/ngày. Trong nghiên cứu này, không có bằng chứng cho thấy Trileptal có hiệu quả với bệnh nhân dưới 2 tuổi (N=75).
Dữ liệu an toàn phi lâm sàng cho thấy không có rủi ro đặc biệt cho người, dựa vào nghiên cứu độc tính khi dùng liều liên tiếp, dược lý học về an toàn và độc tính gen với oxcarbazepine và với chất chuyển hóa còn hoạt tính dược lý, là dẫn xuất monohydroxy (MHD).
Độc tố miễn dịch
Các test kích thích miễn dịch trên chuột nhắt cho thấy MHD (và một mức độ ít hơn với oxcarbazepine) có thể gây ra phản ứng quá mẫn chậm.
Đột biến
Thử nghiệm Ames in vitro cho thấy Oxcarbazepine làm tăng tần số đột biến ở một trong 5 chủng vi khuẩn ở điều kiện không kích hoạt trao đổi chất. Oxcarbazepine và MHD làm tăng sai lệch nhiễm sắc thể và/hoặc gây đa bội ở thử nghiệm in vitro với buồng trứng chuột Hamster Trung Quốc, trong điều kiện không kích hoạt trao đổi chất. MHD âm tính trong thử nghiệm Ames và khôn
g thấy tác động gây đột biến hoặc bất thường nhiễm sắc thể ở cả oxcarbazepine và MHD trong tế bào chuột đồng Trung Quốc V79 in vitro. Trong một thử nghiệm với tủy xương chuột in vivo Oxcarbazepine và MHD đều âm tính với tác động làm bất thường nhiễm sắc thể và hình thành vi nhân.
Gây ung thư Trong những nghiên cứu về độc tính gây ung thư, có thấy thuốc gây ra u ở gan (chuột cống và chuột nhắt), ở các tế bào hạt của tinh hoàn và ở đường sinh dục con cái (chuột cống). Các u ở gan thường là hậu quả của sự gây cảm ứng của thuốc tới các enzym microsom gan, tác dụng gây cảm ứng này yếu hoặc không có ở bệnh nhân dùng Trileptal, mặc dầu cũng chưa có thể loại trừ. Những khối u ở tinh hoàn có thể bị gây nên do các nồng độ cao của hormon hướng hoàng thể. Do không có những sự tăng sinh | bất thường này ở người, nên những u này được cho là không có ý nghĩa thích đáng ở lâm sàng. Nghiên cứu với chất chuyển hóa MHD về độc tính gây ung thư trên chuột cống, thấy có tăng phụ thuộc liều lượng về tỷ lệ các khối u ở tế bào có hạt ở đường sinh dục của chuột cái (cổ tử cung và âm đạo). Những tác dụng độc này đạt được với các nồng độ phơi nhiễm ngang với sự phơi nhiễm trong lâm sàng. Chưa giải thích được cơ chế phát triển các khối u đó, nhưng có thể liên quan đến sự tăng nồng độ estradiol, đặc biệt ở chuột. Ý nghĩa lâm sàng của các khối u trên chưa rõ.
Độc tính sinh sản
Mục độc tính sinh sản, xem mục PHỤ NỮ CÓ THAI, CHO CON BÚ VÀ KHẢ NĂNG SINH SẢN.
Mục lục
Toggle Hộp 10 vỉ x 10 viên
Hộp 10 vỉ x 10 viên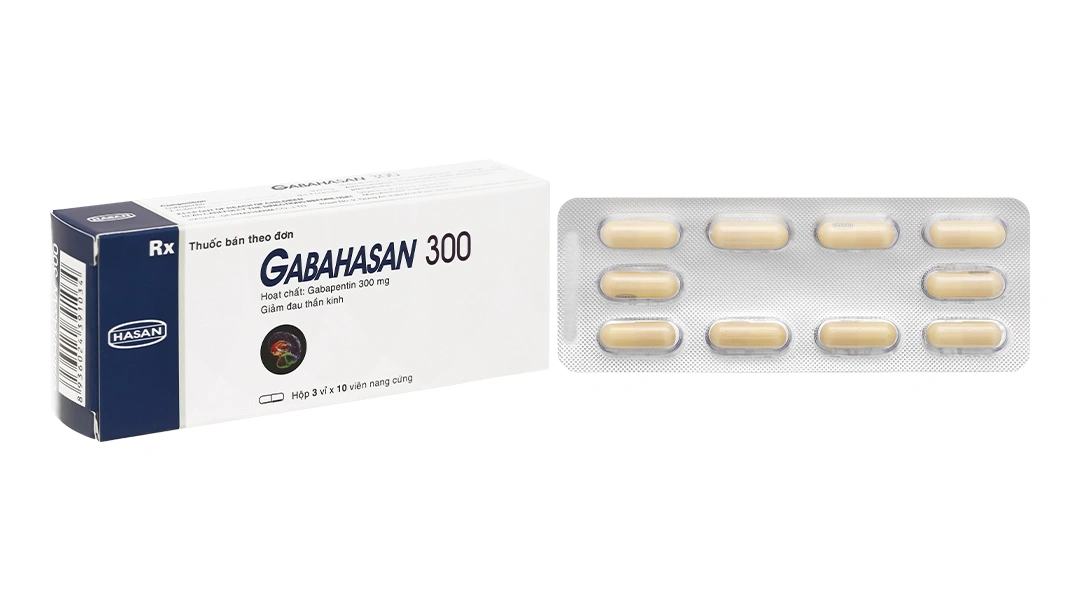 Hộp 3 vỉ x 10 viên
Hộp 3 vỉ x 10 viên Hộp 6 vỉ x 10 viên
Hộp 6 vỉ x 10 viên Hộp 4 vỉ x 14 viên
Hộp 4 vỉ x 14 viên Hộp 10 vỉ x 10 viên
Hộp 10 vỉ x 10 viên Hộp 6 vỉ x 5 vỉ x 5ml
Hộp 6 vỉ x 5 vỉ x 5ml









Chưa có đánh giá nào.